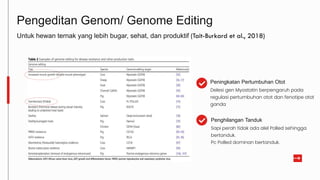
Teknologi rekayasa genetika pada hewan ternak dikembangkan untuk berbagai tujuan seperti meningkatkan produktivitas, kesehatan, dan kesejahteraan hewan serta mengurangi biaya produksi. Namun, terdapat berbagai tantangan teknis, regulasi, dan persepsi publik yang perlu dipertimbangkan sebelum diterapkannya teknologi ini secara komersial. Diskusi interdisipliner diperlukan dalam menangani isu-isu kompleks