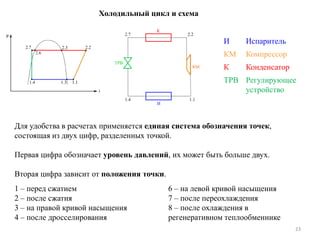
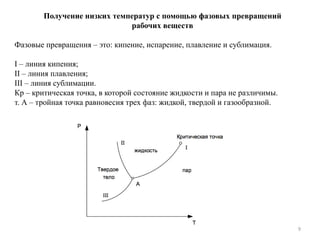
Документ описывает основы и технологии холодильной и криогенной техники, включая определения, термодинамические процессы и сферы применения. Упоминаются основные концепции, законы термодинамики, а также различные технологии, используемые в промышленности, медицине и энергетике. Также рассматриваются схемы и процессы холодильных машин и методы получения низких температур.
















![18
Параметры цикла
Давление p [атм, бар, МПа]
Температура t [°С, К]
Энтальпия i [кДж/кг]
Энтропия s [кДж/кг·К]
Холод
Q0 [кВт холода, кДж/c] холодопроизводительность
q0 [кДж/кг] удельная холодопроизводительность
Тепло
Qк [кВт тепла, кДж/c] теплопроизводительность
qк [кДж/кг] удельная теплопроизводительность](https://image.slidesharecdn.com/random-160918141307/85/slide-18-320.jpg)