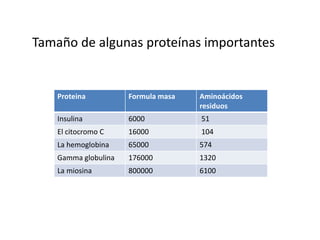
Las proteínas son polímeros formados por cadenas de aminoácidos unidos por enlaces peptídicos. Tienen estructuras primarias, secundarias, terciarias y cuaternarias que determinan su función. La estructura secundaria incluye hélices alfa y hojas beta mantenidas por puentes de hidrógeno. La estructura terciaria se pliega en 3D debido a interacciones laterales de la cadena. Algunas proteínas están formadas por subunidades, mostrando estructura cuaternaria. La hemoglob