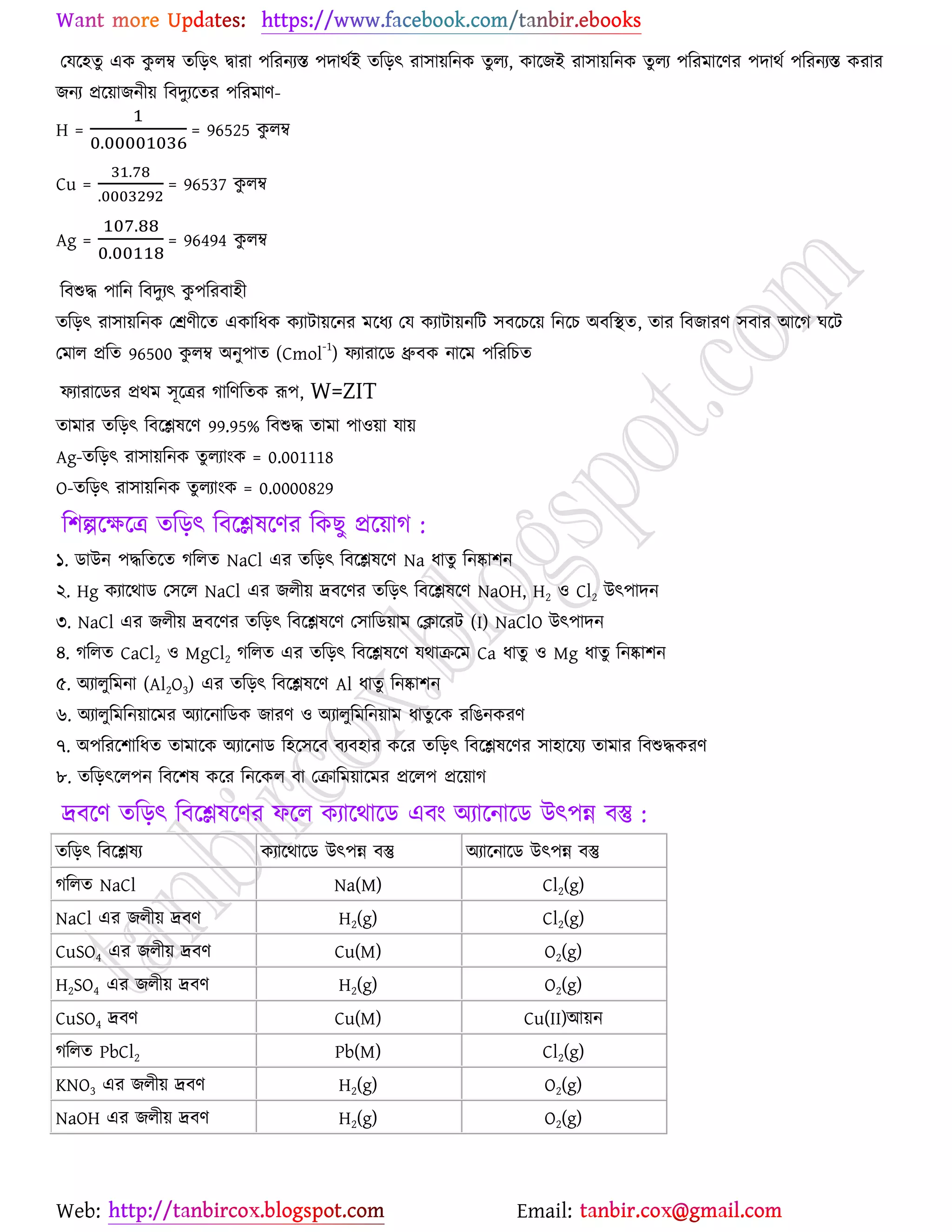
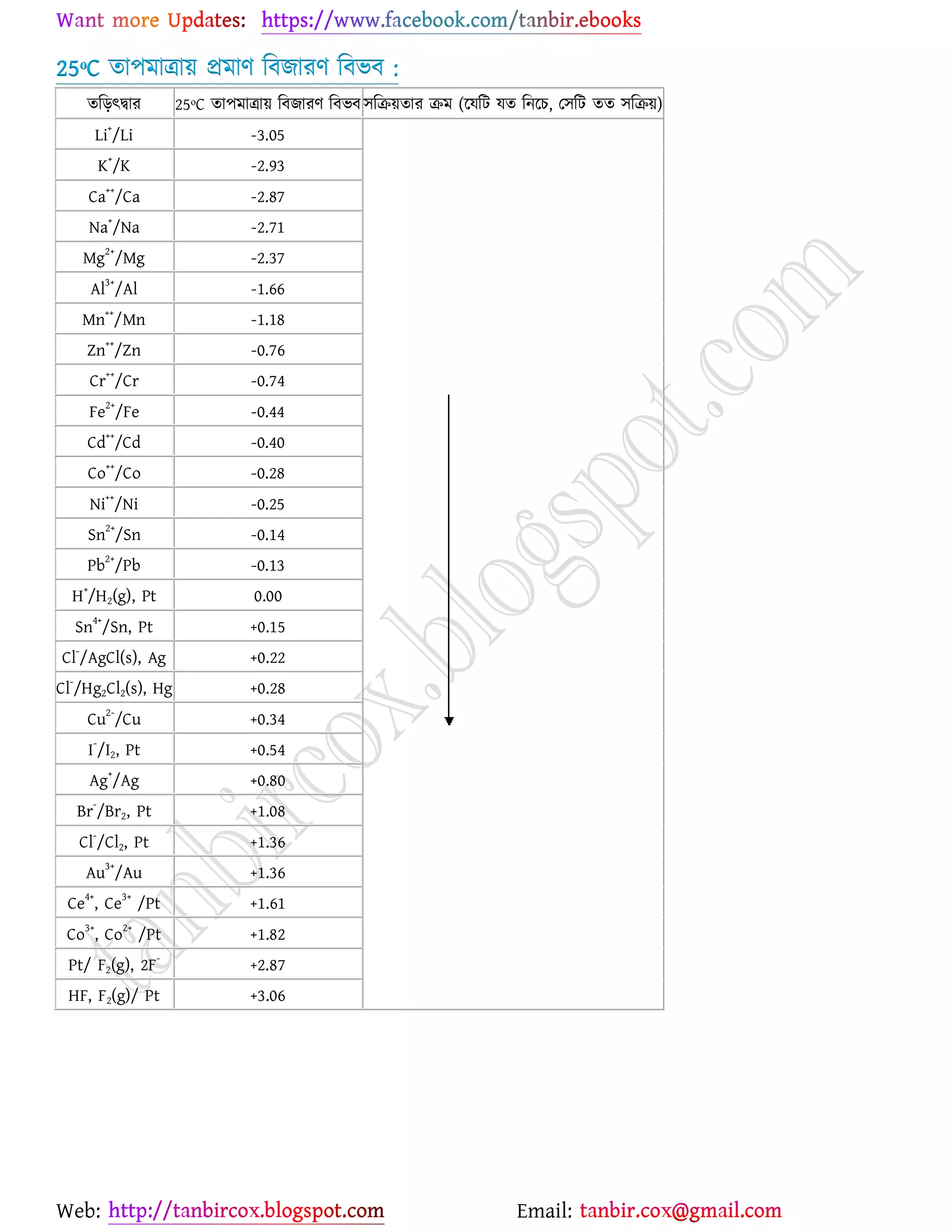
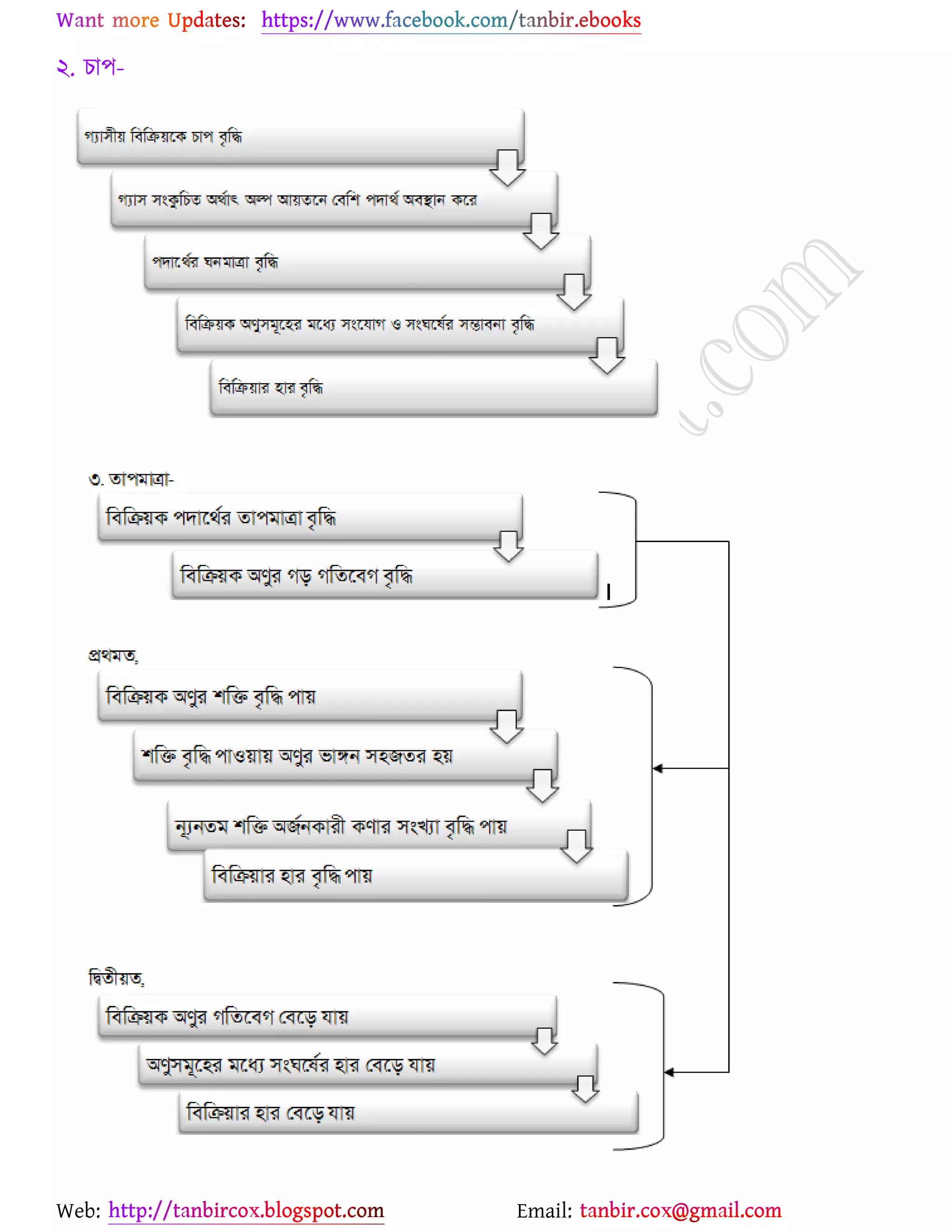
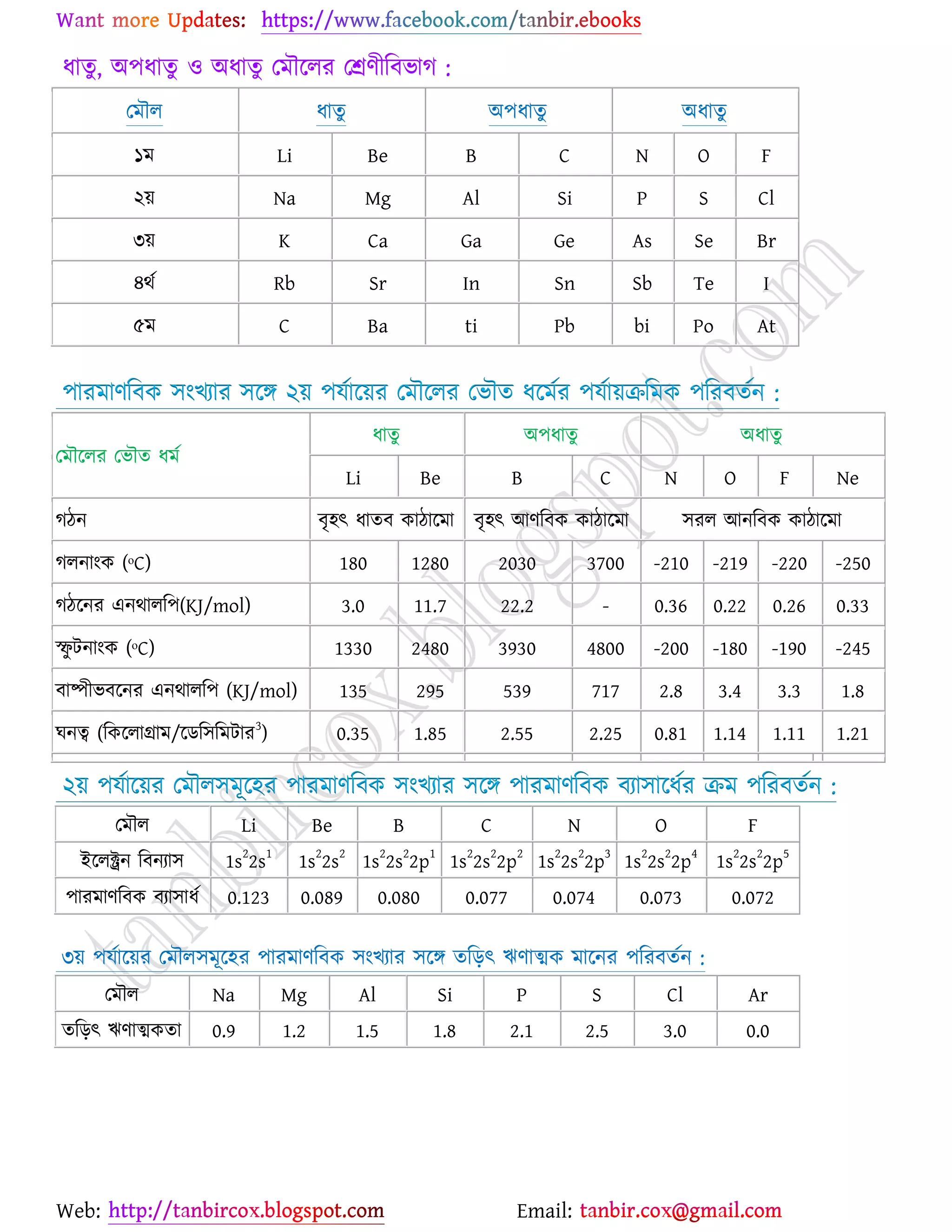
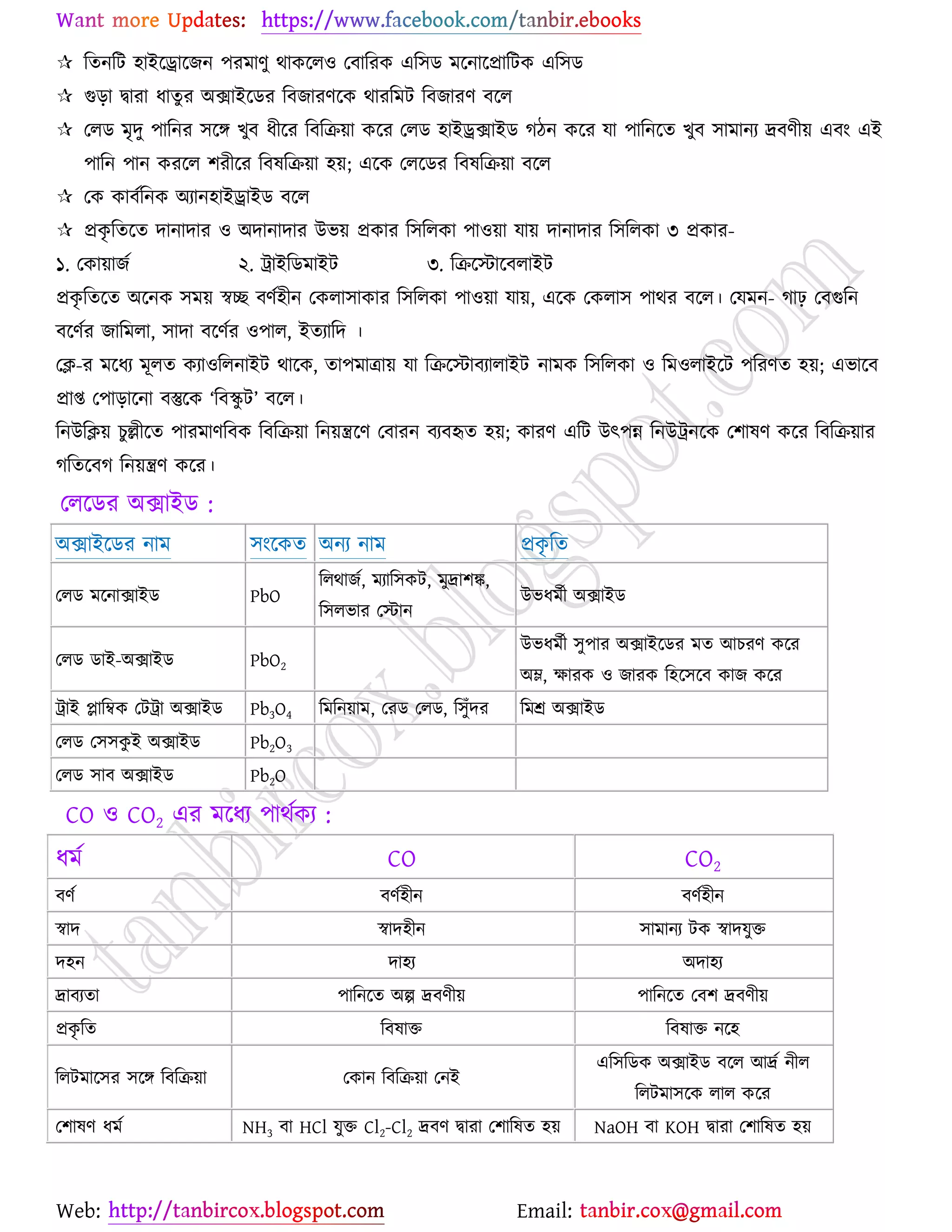
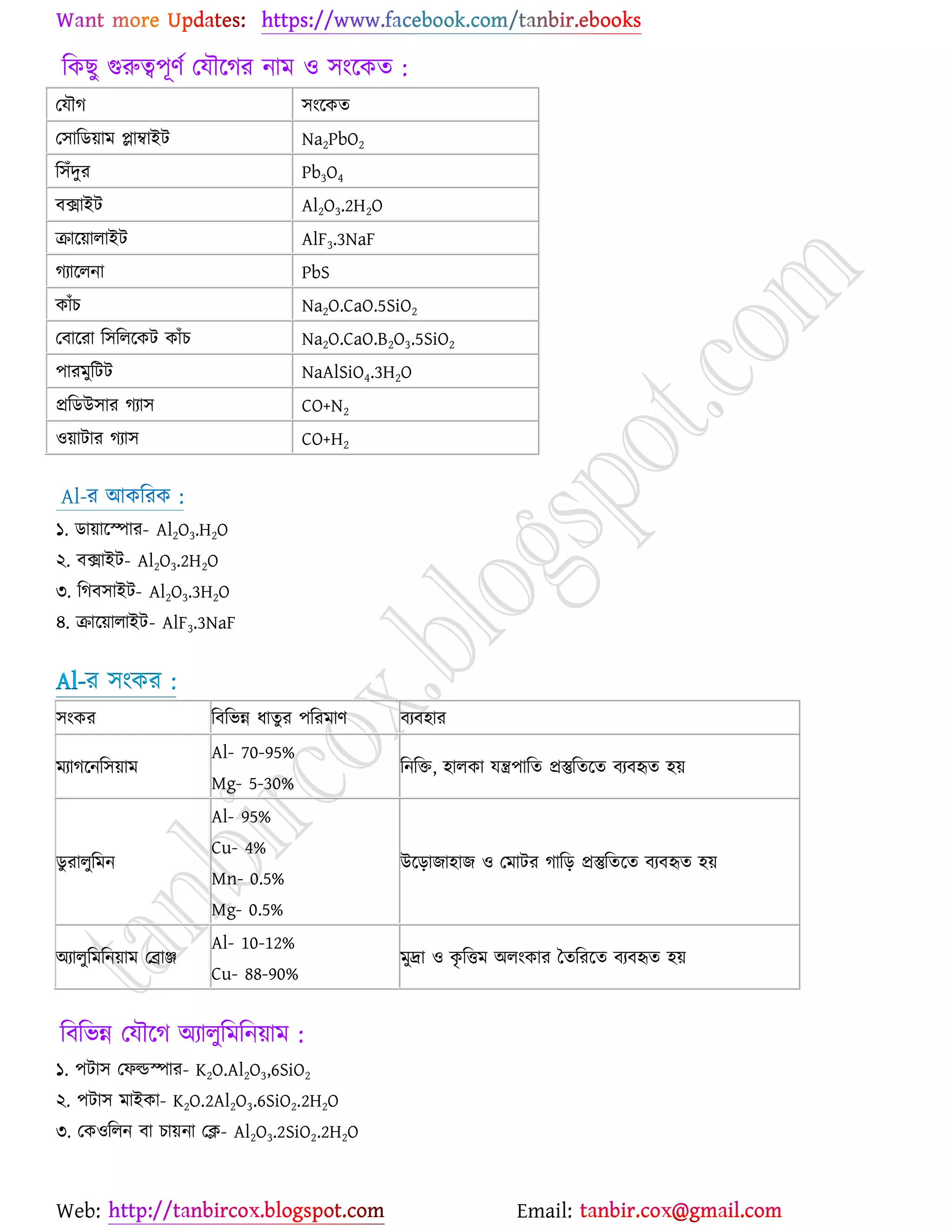
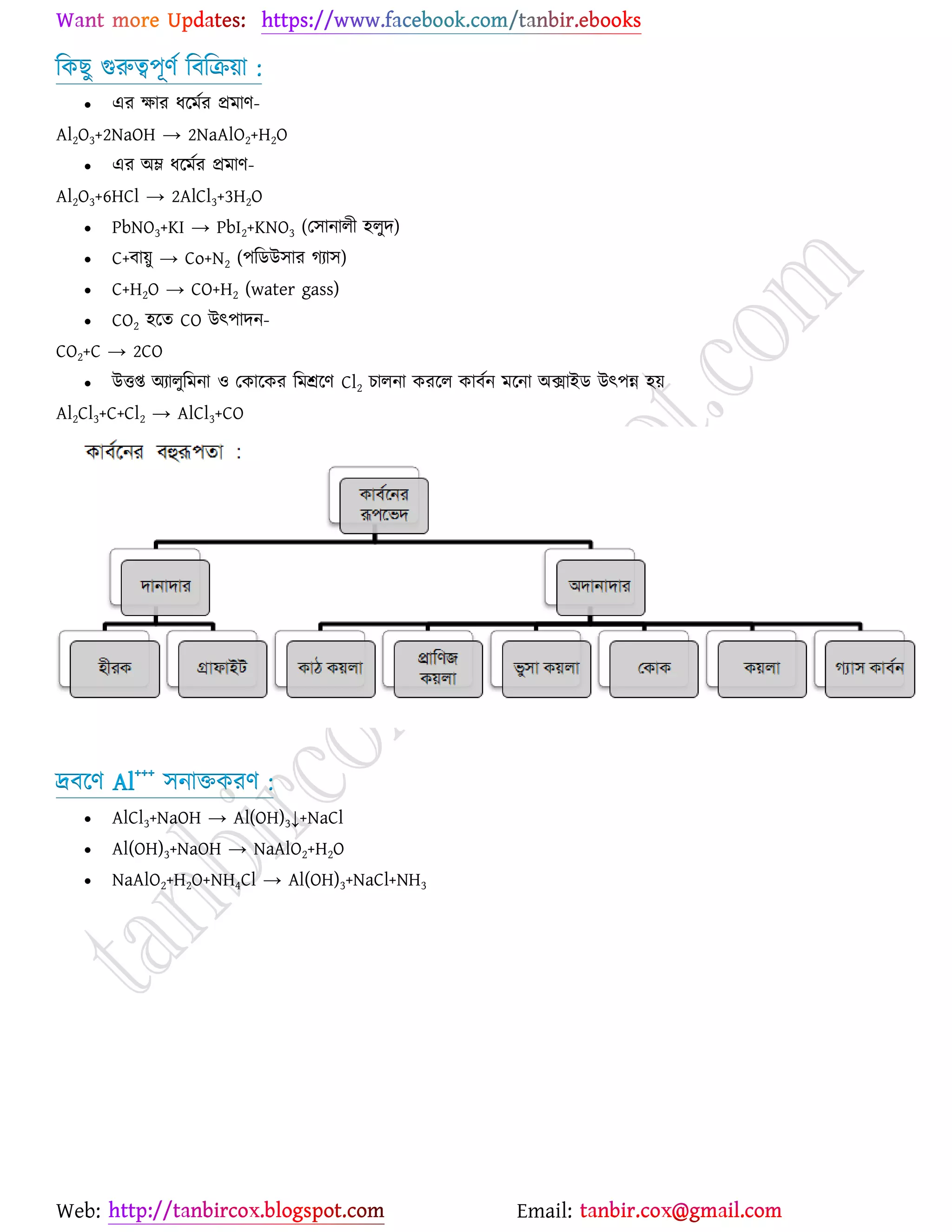
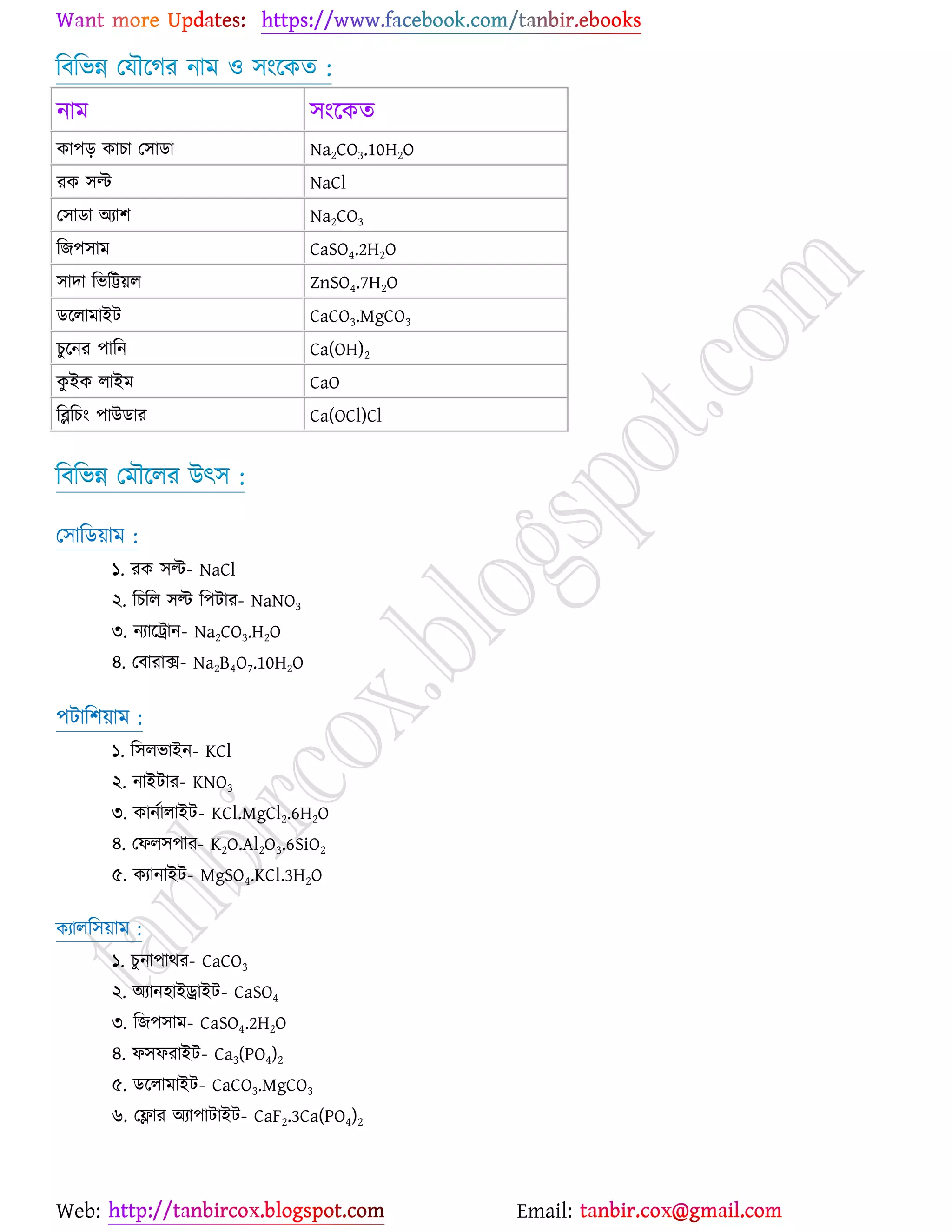
উচ্চমাধ্যমিক (HSC) ও ইউনিভার্সিটি ভর্তির জন্য প্রয়োজনীয় সব লেকচার শিট
* প্রশ্ন উত্তর গুলো বিভিন্ন লেখকের বই
থেকে যাচাই বাছাই করে সবচেয়ে সহজ পদ্ধতির উত্তরটা দেওয়া হয়েছে
* রসায়নের মৌলিক গুরুত্বপূর্ন
বিষয়সমূহ সম্পর্কে খুব সহজ ব্যখ্যা দেওয়া আছে?
* জটিল তত্ব গুলো বুঝার জন্য চিত্র সহকারে
উদাহরন দেওয়া আছে
* রসায়নের গুরত্বপূর্ন বিষয়সমূহের
প্রয়োজনীয় উদাহরণ ও চিত্রসহ ব্যাখ্যামূলক সমাধান করে দেওয়া হয়েছে ।
* গাণিতিক প্রশ্ন উত্তর গুলো ভেঙ্গে ভেঙ্গে
বিস্তারিত ভাবে ও প্রয়োজনীয় সাইডনোট সহকারে করে দেওয়া আছে ।





![Web: Email:
07. কযাভূর্য যদার্রয উয অনুভূর্য অরফযাভ াংখর্লেয পর্র কযা ঘার্য ৃরষ্ট্ ।
08. অণুভূর্য যভাট করতরত তথা প্ররতরট অণুয কড় রত যভ তাভাত্রায ভানুারতও।]
চানর্ত র্ফ....
যভ ূনয তাভাত্রা র 0K অথফা -273
0
C.
াইর্রার্চন অণুয ফকেভূর কড়-ফকে করতর্ফক ওক্ষ তাভাত্রা যর্ওর্ন্ড প্রা 2km.
ররচাভ যিাযাইর্ি Cs+ I Cl- এয ফযাাধে মথাির্ভ 167 181 pm.
কযার্য প্রাযাাংও 273
STP = Standard Temperature & Pressure.
SATP = Standard Ambient Temperature & Pressure.
S.T.P যত প্রভাণ তাভাত্রা = 0
0
ফা 237K , প্রভান ঘা = 760 রভ.রভ. (াযদ) ফা 1 ফাুঘা ফা 76cm ফা 101.325
kPa
SATP যত ঘার্য এওওঃ 10
2
kPa,তাভাত্রা 25
0
C. আতন 24.789 ltr.
অযার্বার্কর্রা াংঔযা, NA = 6.023× 1023
H2 I He যক্ষর্ত্র উৎিভ তাভাত্রা মথাির্ভ -80
0
C I -240
0
C.
S.T.P যত ১ যভার কযার্য আতন ২২.৪ রর.
তাভাত্রা ফৃরদ্ধ ওযর্র কযার্য করতরত ফৃরদ্ধ া, T
0
KE
ারপার্যয অণুর্ত (S8) আটরট যভাণু আর্ঙ।
পপযার্য অণুর্ত (P4) ঘাযরট যভাণু আর্ঙ।
NaCl, যানা, যরাা ীযর্ওয করনাাংও মথাির্ভ 801
0
C, 1063
0
C, 1540
0
C, 3600
0
C
1 kg তযর ারনয আতন 1L রওন্তু 1000
C তাভাত্রা 1 ফাুভন্ডরী ঘার্ 1 kg চরী ফার্ষ্পয আতন প্রা
1245 L.
R (র্ভারায কযা ধ্রুফও)- এয ভান রফরবরফন্ন এওর্ও:
01.ররটায ফাুঘা এওর্ও 0.0821 L. atm. K
-1
mol
-1
02. এ. আই এওর্ও 8.314 JK-1
mol-1
03. র.রচ.এ এওর্ও 8.32× 107
erg.K-1mol-1
04. ওযাররয এওর্ও 1.987 cal K
-1
mol
-1
k.(র্ফারট্চভযান ধ্রুফও)- এয ভান রফরবরফন্ন এওর্ও
01. ররটায-ফাুঘা এওর্ও 136× 10
-25
L.atm.K-1molecule-1
02. চুর ফা এ.আই এওর্ও 1.38× 10
-25
Jk-1molecule-1
ফযপ ারনর্ত রূান্তরযত র্র আতন ওর্ভ, খনত্ব ফার্ড়।
তযর্রয যক্ষর্ত্র অণুয স্থানান্তয করত আন্তআণরফও ফর প্রা ভান।
কযার্য যক্ষর্ত্র আন্তঃআণরফও ফর অর্ক্ষা অণুয স্থানান্তয করত অরধও।
উচ্চ আণরফও ফর রফরষ্ট্ দার্থেয করনাাংও স্ফু টনাাংও উচ্চ।](https://image.slidesharecdn.com/intermediatechemistrypart-01-130509161414-phpapp02/75/Intermediate-chemistry-part-01-6-2048.jpg)

![Web: Email:
গুরুত্বূনে তথযঃ
যম ফ ফস্ত্তয করণাঙ্ক ওক্ষ তাভাত্রায উর্য তা ওক্ষ তাভাত্রা ওরিন রর্র্ফ থাওর্ফ।
যম ফ ফস্ত্তয স্ফূ টণাঙ্ক ওক্ষ তাভাত্রায রনর্ঘ তা ওক্ষ তাভাত্রা কযা রর্র্ফ থাওর্ফ।
যম ওর দার্থেয করণাঙ্ক ওক্ষ তাভাত্রায রনর্ঘ এফাং স্ফূ টনাঙ্ক ওক্ষ তাভাত্রায উর্য তা ওক্ষ তাভাত্রা তযর
রর্র্ফ থাওর্ফ।
SI এওর্ও ঘা আতর্নয এওও মথাির্ভ যার্ওর m3
CGS দ্ধরতর্ত ঘার্য এওও িাইন/র্রন্টরভটায২
এফাং আতর্নয এওও যরন্টরভটায৩
ভাউন্ট এবার্যস্ট এ ারনয স্ফু টনাাংও 71
0
C
Conversion Of Unit:
1m
3
= 10
3
dm
3
= 10
6
cm3
1dm3 = 10
3
cm3 = 1L = 1000mL.
[Nm
-2
= Kg ms
-2
m
-2
= Kg m
-1
s
-2
]
1ফাুঘা = 1 atm = 101.325kPa = 1.01 × 10
5
Pa = 1.01× 10
5
Nm
-2
= 760mm(Hg)
IMPORTANT LAWS
ফর্র্রয ূত্রঃ রস্থয তাভাত্রা রনরদেষ্ট্ বর্যয যওান কযার্য আতন তায উয প্রমুত ঘার্য ফযত্মানুারতও।
[ মঔন T রস্থয ]
ঘারের্য ূত্রঃ রস্থয ঘার্ রনরদেষ্ট্ কযার্য আতন যভ তাভাত্রায ভানুারতও। [ মঔন P রস্থয ]
অযার্বার্কর্রায ূত্রঃ রস্থয তাভাত্রা ঘার্ ভআতর্নয যভৌররও যমৌরকও ওর কযার্য ভান াংঔযও অণু থার্ও।
[ মঔন P T রস্থয ]
িারটর্নয আাংরও ঘা ূত্রঃ যওান রনরদেষ্ট্ তাভাত্রা রফরিা রফীন যওান কযা রভশ্রর্ণয যভাট ঘা ঐ তাভাত্রা তায
উাদান কযাভূর্য আাংরও ঘা ভূর্য যমাকপর্রয ভান। P = P1 + P2 + P3 + .......... + Pn
যকরুযার্ওয ঘার্য ূত্রঃ রস্থয আতর্ন রনরদেষ্ট্ বর্যয যওান কযার্য ঘা ঐ কযার্য যভ তাভাত্রায ভানুারতও।
[ মঔন আতন, V রস্থয ]
গ্রাার্ভয ফযান ূত্রঃ রনরদেষ্ট্ ঘা তাভাত্রা যওান কযার্য ফযার্নয ায তায খনর্ত্বয ফকেভূর্রয ফযত্মানুারতও।
√
আদে কযা ভীওযন PV = nRT। যাকে ব্যব্হার েকর কযার্য আণরফও বয খনত্ব রযভা ওযা মা।](https://image.slidesharecdn.com/intermediatechemistrypart-01-130509161414-phpapp02/75/Intermediate-chemistry-part-01-10-2048.jpg)
























![Web: Email:
যারায যমৌক যারায দ্রাফর্ও দ্রফণী।
আরনও যমৌক চরী দ্রফর্ণ ারন াংর্মারচত অফস্থা থাওায প্ররিার্ও চর যমাচন ফর্র।
যওান অণুয যমাচযতা স্তর্য ২রট াংওয অযরফটার থাওর্র অণুরটয কিন যররযরঔও।
ওযাটান মত যঙাট এফাং ঘাচে মত যফর তায যারাযন ক্ষভতা এফাং ভর্মাচী বফরষ্ট্য তর্তা যফর। যমভন- Mg
++
Al
+++
এয ভর্ধয Al
+++
ফা Al
3+
এয আওায যঙাট এফাং ঘাচে যফর া Al
3+
এয যারাযন ক্ষভতা যফর।
অযানান মত ফড় তায যারাযন ক্ষভতা তত যফর।
অর্ারায যমৌক অর্ারায দ্রাফর্ও দ্রফণী।
ারন এওরট িাইর্ার। ারনয অণুর্ত দুইরট রনঃে ইর্রক্ট্রন যচাড় রফদযভান।
AgCl, BaSO4 ারনর্ত অদ্রফণী।
টারাভ যপর্যাাানাইর্িয াংর্ওত র্ে- K4[Fe(CN)6]
টারাভ যপরযাানাইর্িয াংর্ওত র্ে- K3[Fe(Cn)6]
HCl অণুয তুরনা HF অণু অরধও যারায।
এওরট π bond যবর্গ দুরট σ bond বতরয ।
ওাফেন ঙাড়া Be, B, O, S, P, N এফ যভৌর্রয াংওযণ খর্ট।
ওাফের্নয াংওযণ ৩ প্রওায : sp, sp sp
sp
3
াংওযর্ণ ঘাযরট ভভার্নয sp
3
অযরফটার উৎন্ন ওর্য।
sp
3
াংওযণ ঘতুস্তরওী।
sp াংওয অযরফটার যর বযরঔও।
যফনরচন অণু যিার্কানার ফা লড়বু চাওায। এয ঘর্িয প্ররতরট ওাফেন যভাণু sp
2
াংওরযত।
যফনরচর্নয ভতা গ্রাপাইর্ট ইর্রক্ট্রন রির্রাওারাইর্চন খর্ট।
H2S অণুর্ত াইর্রার্চন ফিন যনই ফর্র ইা কযা।
ওযাটান ওতৃেও অযানার্নয যারাযর্নয রবরতর্ত রনর্ম্নাত যাারনও ধর্ভেয ফযাঔযাদান ম্ভফ-
১. অযারর্ওার্র KI দ্রফণী রওন্তু KCl অদ্রফণী।
২. অযারর্ওার্র ররযরির্ন LiCl দ্রফণী রওন্তু অনযানয ক্ষায ধাতু যিাযাইর্ি অদ্রফণী।
৩. ইথার্য FeCl3 দ্রফণী রওন্তু AlCl3 অদ্রফণী।
৪. MgCl2 অর্ক্ষা ZnCl2 অরধও উদ্বাী এফাং বচফ দ্রাফর্ও অরধও দ্রফণী। ZnCl2 এয অরধও র্মাচযতাই তায
ওাযণ।](https://image.slidesharecdn.com/intermediatechemistrypart-01-130509161414-phpapp02/75/Intermediate-chemistry-part-01-47-2048.jpg)







![Web: Email:
অম্ল-ক্ষাযও াভযফস্থা
যওান অম্ল যথর্ও এওরট যপ্রাটন অাযর্ণয পর্র যম ক্ষাযও ৃরষ্ট্ , তার্ও য অর্ম্লয অনুফিী ক্ষাযও ফর্র।
যওান ক্ষাযর্ওয ার্থ এওরট যপ্রাটন াংর্মার্কয পর্র যম অর্ম্লয ৃরষ্ট্ , তার্ও য ক্ষাযর্ওয অনুফিী অম্ল ফর্র।
তীব্র অর্ম্লয অনুফিী ক্ষাযও দুফের এফাং দুফের অর্ম্লয অনুফিী ক্ষাযও তীব্র।
তীব্র ক্ষাযর্ওয অনুফিী অম্ল দুফের এফাং দুফের ক্ষাযর্ওয অনুফিী অম্ল তীব্র।
ব্রনর্স্টি রাউযী (১৯২৩) ভতফাদ অনুার্য- এরি যপ্রাটন দান ওর্য এফাং ক্ষাযও যপ্রাটন গ্রণ ওর্য।
মরদ যওান যমৌর্কয চরী দ্রফণ রার ররটভার্ও নীর ওর্য, তর্ফ তা ক্ষাযও এফাং নীর ররটভার্ও রার ওযর্র তা
অম্ল। আয ররটভার্ যওান রযফতেন না র্র তা রনযর্ক্ষ যমৌক।
যম এরি এওরট ভাত্র যপ্রাটন যদ, তার্ও ভর্নার্প্রারটব এরি ফর্র। যমভন-
HCl → H
+
+ Cl
-
; HCl ভর্নার্প্রারটব এরি
যম এরি এর্ওয অরধও যপ্রাটন যদ, তার্ও ররর্প্রারটও ফা িাইর্প্রারটও অম্ল ফর্র। যমভন-
H2SO4 → 2H+
+ SO4
--
; H2SO4 ররর্প্রারটও ফা িাইর্প্রারটও অম্ল
যম ক্ষাযও এওরট ভাত্র যপ্রাটন যন, তার্ও ভর্নার্প্রারটব ক্ষাযও ফর্র। যমভন-
NH3 + H
+
→ NH4
+
যম ক্ষাযও এর্ওয অরধও যপ্রাটন যন, তার্ও ররর্প্রারটও ফা িাইর্প্রারটও ক্ষাযও ফর্র। যমভন-
PO4
3-
+ 3H
+
→ H3PO4
এরি যপ্রাটন দান ওর্য, ক্ষাযও যপ্রাটন গ্রণ ওর্য।
এরি যপ্রাটন দার্নয য ক্ষাযর্ও এফাং ক্ষাযও যপ্রাটন গ্রর্ণয য এরর্ি রযণত ।
25°C তাভাত্রা ারনয আরনও গুণপর্রয ভান 110-14
PH
= -log[H+
]
রফশুদ্ধ ারনয P
H
= 7
তীব্র এরি দুফের ক্ষার্যয টাইর্ট্রর্ন রভথাইর অর্যঞ্জ ফা রভথাইর যযি ফযফায ওযা ।
ারনয আীনও গুণপর, KW= [OH
-
][H
+
]
ারনয P
h
= P
OH
= -log 10
-7
= 7
দ্রফর্ণ াইর্রার্চন আন াইর্রারনাভ (H3O+
) রার্ফ থার্ও।
যন্ডাযন ভীওযর্ণয াার্ময ফাপায দ্রফর্ণয P
H
এয ভান কণনা ওযা ।
স্বাবারফও অফস্থা যর্তয P
H
= 7.4 থার্ও এফাং এ ভান ফেদা অরযফরতেত থার্ও।
ভারটয P
H
এয ভান 9.5 এয উর্য র্র ভারটয উফেযতা রফনষ্ট্ ।
রফরবন্ন ধযর্নয যাম্পু উৎাদর্ন এরিী ভাধযভ তথা P
H
এয ভান 5.0-5.5, আফায
াফান উৎাদর্ন P
H
এয 7.0 এয অরধও াংযক্ষণ ওযর্ত ।
উফেয ভারটয চনয প্রর্াচনী অতযানুওূ র P
H
ভান র্রা যথর্ও 7.0-8.0](https://image.slidesharecdn.com/intermediatechemistrypart-01-130509161414-phpapp02/75/Intermediate-chemistry-part-01-60-2048.jpg)
![Web: Email:
ভারটয P
H
এয 3.0 এযর্ঘর্ ওভ অথোৎ তীব্র এরিী ফা 10.0 এযর্ঘর্ যফর অথোৎ তীব্র ক্ষাযী র্র ভারট অণুচীফ
(microorganism) ভুত থার্ও।
ভারটয P
H
ভান ভাত্রারতরযত ফৃরদ্ধ যর্র রফরবন্ন নাইর্ট্রট (KNO3, NaNO3, NH4NO3) এফাং পর্পট (ুায পর্পট
রটএর) ায প্রর্াক ওর্য P
H
রনন্ত্রণ অথোৎ ফাপারযাং ওযা ।
যন্ডাযন ভীওযণরট র : P
H
=P
ka
+log
রফন
অম্ল
ইর্রক্ট্রনরফীন াইর্রার্চন আনর্ও যপ্রাটন ফর্র।
ভৃদু এরি ফা ক্ষাযর্ওয যক্ষর্ত্র, Ka ফা Kb = α2
C
রফর্াচন ধ্রুফও, Ka =
ারনয Kc =
[ ][ ]
রফশুদ্ধ ারনয [H
+
] = [OH
-
]= 10
-7
g/dm
3
রফরবন্ন প্রওৃ রতয এরি ক্ষাযও ট্রাইর্ট্রর্ন ফযফহৃত উমুত রনর্দেও :
এরি-ক্ষায উদাযণ ওামেওয P
H
রযয রনর্দেও
তীব্র এরি- ভৃদু ক্ষায HCl-Na2CO3 3.0-6.5 রভথাইর অর্যঞ্জ ফা রভথাইর যযি
ভৃদু এরি- তীব্র ক্ষায CH3COOH-NaOH 8.0-10.0 যপনরপথযাররন
তীব্র এরি- তীব্র ক্ষায HCl-NaOH 3.0-10.0 ফ রনর্দেও
ভৃদু এরি- ভৃদু ক্ষায CH3COOH-NH4OH 0 যওান রনর্দেও যনই
াধাযণ রনর্দের্ওয ফণে রযফতের্নয এয রযয :
রনর্দেও ফণে রযফতের্নয P
H
এয রযয অম্লী দ্রফর্ণ ফণে ক্ষাযী দ্রফর্ণ ফণে
রভথাইর অর্যঞ্জ 3.1-4.0 যকারাী রার রদু
রভথাইর যযি 4.2-6.3 রার রুদ
যপনরপথযাররন 8.3-10 ফণেীন যকারাী
যব্রর্ভা যপনর 3.0-4.6 রুদ নীর
রভথাইর ইর্ার্রা 2.9-4.0 রার রুদ
থাইভর ব্লু 1.2-2.8 রার রুদ
রির যযি 7.2-8.8 রুদ রার
যপনর যযি 6.8-8.4 রুদ রার
যব্রাভথাইভর ব্লু 6.0-7.6 রুদ নীর
ররটভা 6.0-8.0 রার নীর
যব্রার্ভারির রগ্রন 3.8-4.0 রুদ নীর](https://image.slidesharecdn.com/intermediatechemistrypart-01-130509161414-phpapp02/75/Intermediate-chemistry-part-01-61-2048.jpg)



![Web: Email:
প্রভাণ াইর্রার্চন তরড়ৎদ্বায রফবর্ফয ভান ূণয
ধাতুয ফা ধাতফ আন অথফা ইর্রর্ক্ট্রাি এফাং ইর্রর্ক্ট্রারাইর্টয ভর্ধয অফরস্থত তরড়চ্চারও ফরর্ও উস্থার্নয চনয এওরট
রতমেও যযঔা ফযফায ওযা । যমভন- Ag/Ag
+
ফা Pt, H2(g)/H
-
(aq)
Eᵒ যওাল = +, যওাল রফরিা স্বতঃস্ফূ তে বার্ফ খর্ট
অধের্ওার্লয যশ্রণীরফবাক :
১. ধাতু-ধাতফ আন অধের্ওাল
২. ধাতুয অযাভারকাভ-ধাতফ আন অধের্ওাল
৩. ধাতু তায অদ্রফণী রফণ ম্বররত অধের্ওাল
৪. কযা অধের্ওাল
৫. চাযণ-রফচাযণ অধের্ওাল
অযার্নাি অধের্ওাল : যম অধের্ওার্ল চাযণ খর্ট
ওযার্থাি অধের্ওাল : যম অধের্ওার্ল রফচাযণ খর্ট
ক্ষ রফরিা াধাযণত অযার্নার্ি াংখরটত
এওরট ূণোে তরড়ৎ যওার্লয অধের্ওাল ২রটয ভর্ধয যারয াংর্মাকর্ও ভধযফতেীস্থার্ন দুরট ঔাড়া রাইন রদর্ উস্থান ওযা
Zn/ZnSO4 ‖ CuSO4/Cu
রফণ যতু ফযফায ওযর্র ২রট অধের্ওার্লয ভর্ধয র্যাক্ষ াংর্মাক স্থার্নয চনয ২রট ঔাড়া রাইন () ফযফায ওযা
Zn/ZnSO4 ‖ CuSO4/Cu
রফজ্ঞানী নানেস্ট তরড়ৎ যাারনও যওার্লয তরড়ৎঘারও ফর্রয চনয এওরট াধাযণ ভীওযণ প্রওা ওর্যন-
ECell = EO
Cell -−
[ ]
[ ]
এঔার্ন,
ECell = যর র্টনরার
T = যভ তাভাত্রা
n = রফরিা স্থানান্তরযত ইর্রক্ট্রর্নয যভৌর াংঔযা
[ ] = খনভাত্রা
F = প্রফারত রফদুযৎ (পযাযার্ি)
E
O
Cell = যর্রয প্রভাণ র্টনরার
নানের্স্টয প্রস্তারফত তত্ত্বানুার্য, প্রর্তযওরট ধাতু এফাং াইর্রার্চর্নয ধনাত্মও (+) আন রর্র্ফ দ্রফর্ণ মাায এওরট চাত
প্রফণতা আর্ঙ। এ প্রফণতায ওাযর্ণ ধাতুর্ও তায আর্নয দ্রফর্ণ স্থান ওযর্র ধাতু যথর্ও দ্রফর্ণয রদর্ও এওরট ঘার্য ৃরষ্ট্ ।
এ ঘার্ও ধাতুয দ্রফণ ঘা ফর্র।](https://image.slidesharecdn.com/intermediatechemistrypart-01-130509161414-phpapp02/75/Intermediate-chemistry-part-01-66-2048.jpg)











![Web: Email:
রওঙু রফর্ল তথয :
১. Na ধাতু অতযন্ত রি ফর্র ফাতার্য চরী ফার্ষ্পয ার্থ তীব্র রফরিা ওর্য মার্ত আগুন ধর্য যমর্ত ার্য। তাই Na ধাতুর্ও
যওর্যারর্নয রনর্ঘ যাঔা ।
২. গ্রু IA-এয ধাতুগুর্রায দুরট অদ্রফণী রফণ র Na াইর্যা এরন্টর্ভার্নট (Na2H2Sb2O7) এফাং িাই-টারাভ যওাফাল্ট
নাইট্রাইট K2Na[Co(NO2)6]
৩. NaCl CaCOI এয রভশ্রণর্ও রফযঞ্জও রভশ্রণ ফর্র
৪. ুইরভাং ুর্র দুকেি দূযীওযর্ণ 10% NaOCl ফযফহৃত
৫. উন্নত যদর্ রব্লরঘাং াউিার্যয রযফর্তে NaOCl ফযফহৃত
ওরত রফর্ণয ফণে :
যমৌক ফণে
LiCl, NaCl, KNO3, Na2SO4, Na3PO4, Na2CO3 াদা
Na2CrO4, K2Cr2O7 ওভরা
KMnO4 যকারাী/ যফগুরন
যবৌত ধভোফরী :
১. প্রওৃ রত : গ্রু I এয অন্তবু েত ওর যভৌরই ধাতু
২. ফণে : এ ধাতুগুর্রা যদঔর্ত রূায ভত াদা। তর্ফ ফাুর্ত যাঔর্র াদা যাং নষ্ট্ র্ মা।
৩. ধাতফ ফিন প্রওৃ রত : গ্রু I যভৌর্রয যভাণুয ফরঃস্তর্য এওরট ভাত্র যমাচযতা ইর্রক্ট্রন(ns
1
) থাওা এযা দুফের ধাতফ ফিন কিন
ওর্য। গ্রু II যভৌরগুর্রায ফরঃস্তর্যয যর্র দুরট ইর্রক্ট্রন (ns
2
) আর্ঙ ফর্র এফ ধাতুর্ত ধাতফ ফিন তু রনাভূরও দৃঢ় ।
৪. নভনীতা : ধাতফ ফিন দুফের া এ ধাতুগুর্রা নযভ; এতই নযভ যম ঙুরয রদর্ ওাটা মা।
৫. াযভাণরফও আরনও আওায : াধাযণত মো াযণীয যম যওান গ্রুর্য উয যথর্ও রনর্ঘয রদর্ও িভান্বর্ াযভাণরফও
ফযাাধে ফৃরদ্ধ া।
৬. খনত্ব : গ্রু I-য ধাতুগুর্রায াযভাণরফও াংঔযা ফৃরদ্ধয ার্থ ার্থ খনত্ব ফৃরদ্ধ া। মরদ যারিার্ভয যঘর্ টারাভ ারওা।
গ্রু II-য যক্ষর্ত্র Be যথর্ও Ca মন্ত প্রথর্ভ খনত্ব ওর্ভ এফাং তাযয Ra মন্ত ভান যভাণুয িভার্ঙ্কয ার্থ ফৃরদ্ধ যর্ত থার্ও।
৭. করনাাংও স্ফু টনাাংও : ক্ষায ধাতুগুর্রায করনাাংও স্ফু টনাাংও াযভাণরফও াংঔযায র্ে র্ে িভান্বর্ হ্রা যর্ত থার্ও।
যমভন- Li যথর্ও Cs মন্ত করনাাংও 180ᵒC যথর্ও 28ᵒC এফাং স্ফু টনাাংও 1330ᵒC যথর্ও 690ᵒC হ্রা া।
৮. আরনওযণ রত : গ্রু I II যভৌরভূর্য যক্ষর্ত্র মতই রনর্ঘয রদর্ও মাা মা ততই যভৌরভূ রি ।
৯. যাারনও রিতা : গ্রু IA IIA যভৌরভূর্য যক্ষর্ত্র মতই রনর্ঘয রদর্ও মাা মা ততই যভৌরভূ রি ।
১০. রিতা িভ : Cs > Rb > K > Na > Li Ba > Ra > Ca > Mg > Be
রওঙু গুরুত্বূণে উৎাদন প্রণারী :
Na ধাতু রনষ্কান ১. িাউন প্রণারী ২. ওাস্টনায প্রণারী
NaOH উৎাদন
১. Na2CO3 র্ত ক্ষাযীওযণ দ্ধরত
২. কাঢ় NaCl র্ত তরড়ৎ রফর্িলণ দ্ধরত
Na2CO3 উৎাদন ১. রর্ব দ্ধরত ২. যর-ব্লযাাংও দ্ধরত ৩. বফদুযরতও দ্ধরত
Na যিার্যট ফা Na াইর্ার্িার্যট উৎাদন
(i) 2NaOH+Cl2→2NaOCl+H2O
(ii) NaCl(aq)+[O] ⇋ NaOCl(aq)
(iii) 2NaOH(aq)+Cl2(g)→NaCl+NaOCl+H2O](https://image.slidesharecdn.com/intermediatechemistrypart-01-130509161414-phpapp02/75/Intermediate-chemistry-part-01-85-2048.jpg)
![Web: Email:
NaOCl-য ধভে :
১. যারিাভ াইর্ার্িাযাইট যতভন ুরস্থত ন। অল্প তার্ যবর্গ রকর্ যিার্যট যিাযাইি রূান্তরযত ।
3NaOCl ⇆ NaClO3+2NaCl
এ চনযই এরট প্রস্তুর্তয ভ ীতর দ্রফণ ফযফায ওযা ।
২. এওরট রতারী চাযও।
NaOCl→NaCl+[O]
রব্লরঘাং াউিায : ওযাররাভ যিার্যা াইর্ার্িাযাইটর্ও [Ca(OCl)Cl] রব্লরঘাং াউিায ফর্র। 40ᵒC উণতা উতি শুষ্ক
ওররঘুর্নয ভর্ধয যিারযন ঘারনা ওযর্র রব্লরঘাং াউিায উৎন্ন ।
Ca(OH)2+Cl2→Ca(OCl)Cl+H2O
রর্ব দ্ধরত ফা যািা দ্ধরত :
ভূরনীরত : এ দ্ধরতর্ত NaCl যথর্ও যািা অযা (Na2CO3) প্রস্তুত ওযা । কাঢ় NaCl দ্রফণর্ও প্রথর্ভ NH3 কযা দ্বাযা
ম্পৃত ওযা এফাং র্য এর্ত CO2 কযা ঘারনা ওযর্র NH4HCO3 উৎন্ন । যর্ল NH4HCO3 এফাং NaCl যস্পর্যয
ার্থ রফরিা ওর্য ওভ দ্রফণী NaHCO3 NaCl উৎন্ন ওর্য। অধঃরক্ষি NaHCO3-যও যঙুঁর্ও 180ᵒC এ বস্ভীবূ ত ওযর্র
এরট রফর্ারচত র্ Na2CO3-এ রযণত ।
NH3+H2O → NH4OH
2NH4OH+CO2 → (NH4)2CO3+H2O
(NH4)2CO3+CO2+H2O → 2NH4HCO3
NaCl+NH4HCO3 ⇋ NaHCO3+NH4Cl
2NaHCO3 Na2CO3+H2O+CO2
প্রর্াচনী ওাুঁঘাভার :
১. ব্রাইন
২. NH3
৩. ঘুনাাথয](https://image.slidesharecdn.com/intermediatechemistrypart-01-130509161414-phpapp02/75/Intermediate-chemistry-part-01-86-2048.jpg)