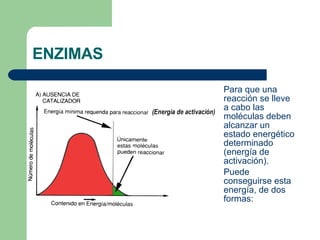
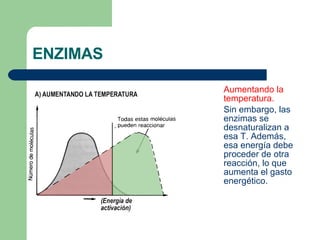
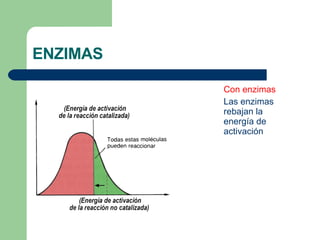
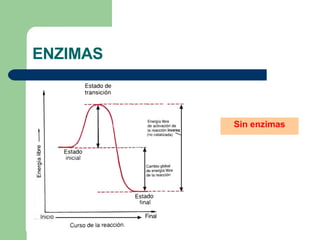
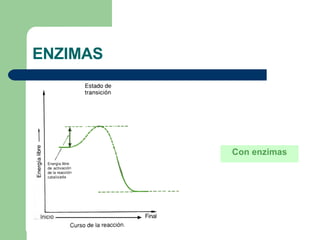
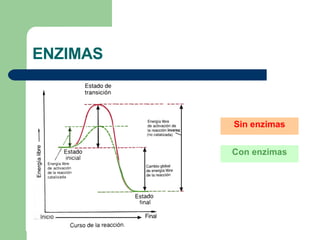
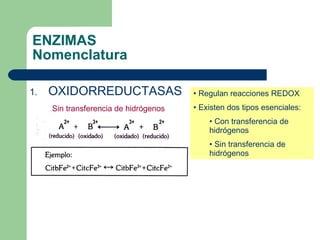
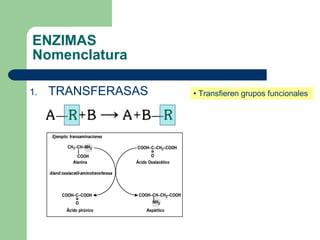
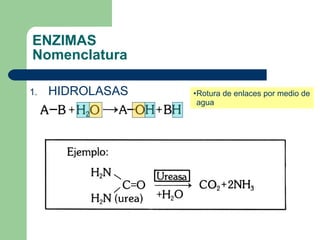
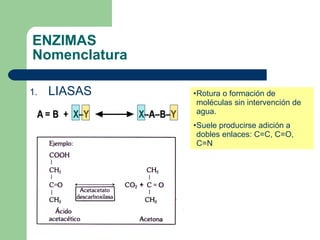
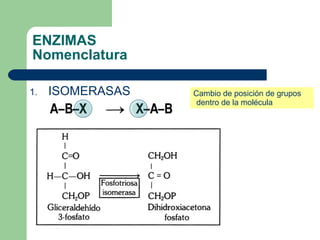
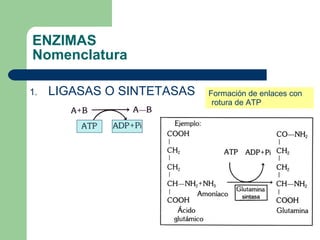
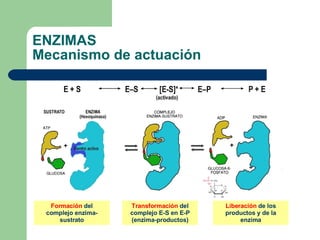
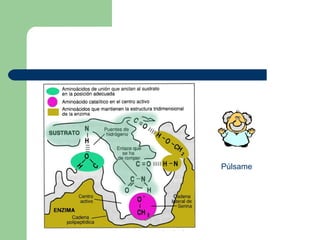
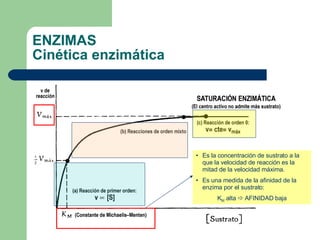
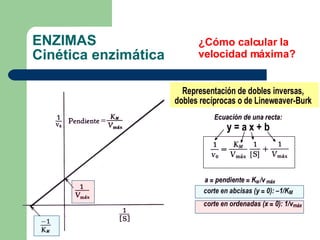
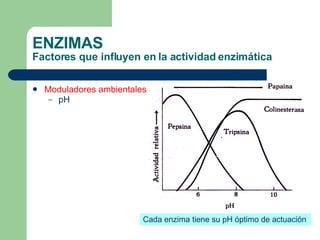
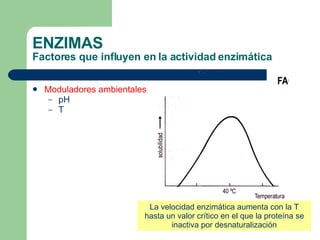
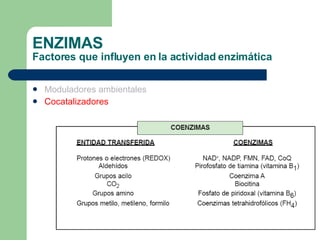
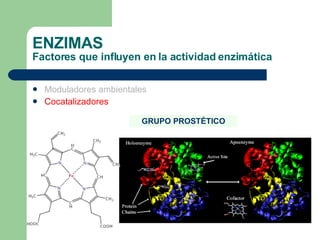
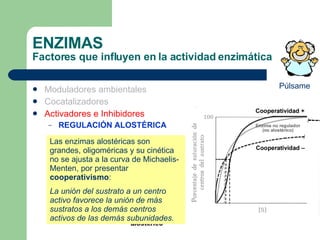
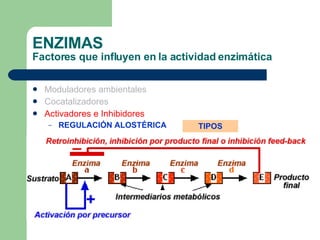
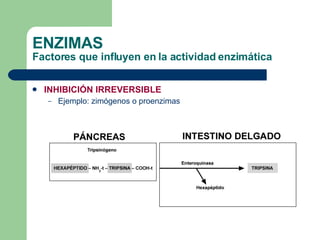
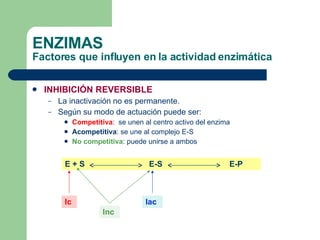
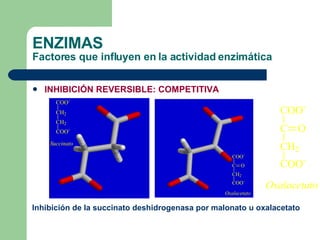
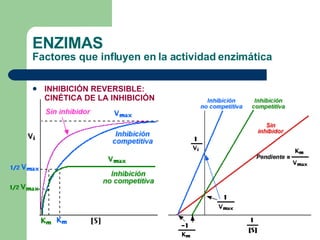
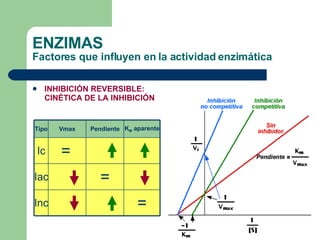
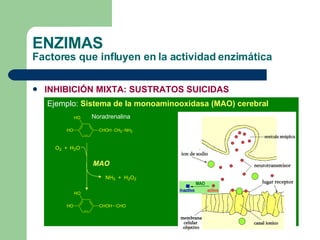
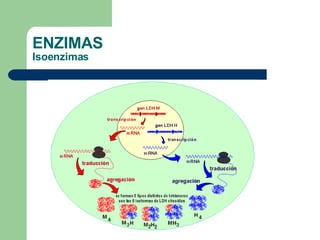
El documento describe las propiedades y factores que afectan la actividad de las enzimas. Las enzimas son proteínas que actúan como catalizadores, rebajando la energía de activación necesaria para que ocurran las reacciones bioquímicas. Su actividad puede verse afectada por factores ambientales como el pH y la temperatura, así como por la presencia de cofactores, activadores e inhibidores.