More Related Content
PPT
PDF
วิชาเคมี มัธยมปลาย เรื่องปฏิกริยากรดเบส PDF
PPT
PDF
การคำนวณเกี่ยวกับสูตรเคมี PDF
PPT
PDF
What's hot
PDF
วิชาเคมี มัธยมปลาย เรื่องปฏิกริยาไฟฟ้าเคมี PPT
PDF
PDF
PPT
PDF
PDF
PPT
PPT
PPT
PDF
PPT
PPS
PDF
บทที่ 3 ปริมาณสารสัมพันธ์ PDF
PDF
PPTX
PDF
ปริมาณสารสัมพันธ์ - Stoichiometry PPT
PDF
Viewers also liked
PPTX
Ion exchange and different types of ion exchanger PPT
PPTX
PPT
PPT
Week 7 Clay And Ion Exchange (1) PDF
Investigation of the Potential Use of (IILs) Immobilized Ionic Liquids in Sha... PPTX
production of citric acid. PPTX
PPT
Ion Exchange Chromatography, ppt PPSX
Similar to 3.2 สมดุลแบบต่างๆ
PPT
PPT
PPT
PPT
PDF
PDF
เคมีดดดดดดดดดดดดดดดดดดกกกกกกกกกกกกกกกกกกกกกกกกกกกกกกก PDF
PPT
PPT
DOC
โจทย์อัตราการเกิดปฎิกิริยาเคมี DOC
DOC
DOC
โจทย์อัตราการเกิดปฎิกิริยา พร้อมเฉลย DOC
PDF
PDF
PDF
AnalChem: Complexometric titration DOC
โจทย์อัตราการเกิดปฏิกิริยาเคมี DOC
PDF
More from Pipat Chooto
PPT
PPT
Key to voltammetry exercise PPT
DOC
แบบฝึกหัด Coulometry & electrogrovimetry DOCX
DOCX
PPT
PPT
PPT
Electrogravimetry and coulometry PPT
PPT
PPT
PPT
PPT
Electrogravimetry and coulometry PPT
PPT
PPT
3.2 สมดุลแบบต่างๆ
- 1.
- 2.
- 3.
- 4.
- 5.
- 6.
- 7.
- 8.
- 9.
- 10.
- 11.
- 12.
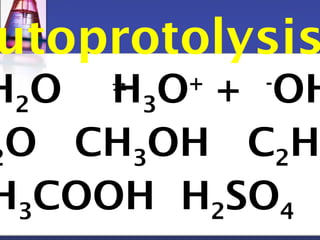
O+ ]รวม=[ H3O+]กรด+[ H3O+ ]รวม=[ H3O+ ]กรด+[ -OH O+ ]รวม=[ H3O+ ]กรด+ Kw/[ H3O+ - 13.
- 14.
- 15.
- 16.
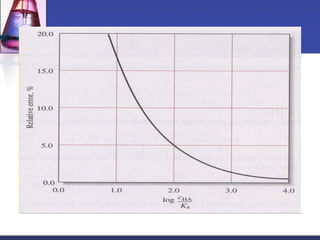
³1000
c
HA
K
a
สมการรูปง่าย
เงื่อนไขเดียวกัน
สำาหรับเบสอ่อน
- 18.
- 19.
- 20.
- 21.
- 22.
mmol Ag NO3=
25.00x0.0640 =
1.6
mmol NaBr =
20.00x0.0250 =
0.5
- 23.
- 24.
- 25.
- 26.
[IO3
-]2 =1.57x10-= 2[Ba2+]
Ba2+](2 [Ba2+])2 = 1.57x10-2x
- 27.
- 28.
- 29.
A++ X- A2X2A++X2-
2y y
X-] = Ksp [A+]2 [X2-] = Ksp
= Ksp [ 2y]2[y] = Ksp
4y3 = Ksp
= s = / 4 3 Ksp y= Ksp
- 30.
- 31.
- 32.
- 33.
IO3
- ]รวม =
IO3
- ] excess
[IO3
- ]การละลา - 34.
- 35.
Ba2+] = s=Ksp
[IO3
- ]2
=1.57x10-9
(0.0200)2
=3.93x10-6 mol/ - 36.
- 37.
- 38.
- 39.
- 40.
[ H O
]
+ -
= ´
= ´ ´
+ -
-
H O Û H O +
OH
2 3
+ + =
x b b ac
a
ax bx c
2
4
0
7.8 10
0.120 5.1 10
2
2
3
4
3
= - ± -
- 41.
- 42.
- 43.
- 44.
- 45.
- 46.
- 47.
- 48.
- 49.
- 50.
2
K aa
sp Ca 2
+ F
-
Ca f F f
[ 2 + ] [ -
]
2 2
2
1 ( 0.0125 2 2 0.0125 2
2
)
2
0.0500
=
= ´ + ´
=
=
+ -
m
Ca f
- 51.
- 52.
- 53.
[ + ][-
]
[ ]
K NH OH b
-
14
-
10
5
3
4
=
= ´
1.00 10
´
5.70 10
1.75 10
-
= ´
NH
- 54.
[ NH +] =
[ -
OH
]
[ 4
NH +
] + [ NH ]
=
c
4 3
NH
3
=
0.0750
M
[NH ] = 0.0750
-
[ -
OH]
3
- 55.
[ ]
2
[ ]
2
[ ]
[ ] 3
5
2 2 5
- - -
» ´ ´ ´
7.50 10 1.75 10
1.15 10
1.75 10
7.50 10
OH
- -
-
- -
-
= ´
= ´
´ -
OH
OH
OH
- 56.
- 57.
[ ] [-
]
[ ]
K =
HOCl OH
K K
= = ´
1.00 10
7
-
14
8
8
w
b
3.33 10
3.0 10
3.0 10
-
-
-
-
= ´
´
= ´
a
b
K
OCl
- 58.
[ OH ]=
[ HOCl
]
[ OCl ] + [ HOCl
]
=
[ - ] 0.0100
[ -
]
0.0100
0.0100
»
= -
-
-
OCl OH
- 59.
[ ]
[]
[ ] 5
7
áá
2
= ´
3.33 10
5.8 10
-
OH
OH
0.0100
0.0100
- -
-
-
= ´
OH






![การแตกตัวของ
นำ้า
ต้องทราบวิธีคำานวนใน
กรณีกรด/เบส มีความเข้ม
ข้นน้อย
[ H3O+ ]รวม= [ H3O+ ] กรด+
[ H3O+ ] นำ้า](https://image.slidesharecdn.com/3-140929013944-phpapp01/85/3-2-8-320.jpg)


![สมการทั่วไป:
[ H3O+ ]รวม=[ H3O+ ]
กรด+[ H3O+ ]นำ้า
กรดแก่: [ H3O+ ] =
cA
กรดแก่เจือจางมาก :](https://image.slidesharecdn.com/3-140929013944-phpapp01/85/3-2-11-320.jpg)
![O+ ]รวม=[ H3O+ ]กรด+[ H3O+ ]รวม=[ H3O+ ]กรด+[ -OH O+ ]รวม=[ H3O+ ]กรด+ Kw/[ H3O+](https://image.slidesharecdn.com/3-140929013944-phpapp01/85/3-2-12-320.jpg)
![กรด HA +H2O
H3O+ + A-Ka
= [H3O+][A-]
[HA]
[A-] =[HO+]](https://image.slidesharecdn.com/3-140929013944-phpapp01/85/3-2-13-320.jpg)
![cHA = [A-] +
[HA]
[HA] = cHA
-[H3O+]
Ka =](https://image.slidesharecdn.com/3-140929013944-phpapp01/85/3-2-14-320.jpg)
![H3O+] << cHA
Ka = [HO+]3c [ ] HA H O+ = c K
3
HA a](https://image.slidesharecdn.com/3-140929013944-phpapp01/85/3-2-15-320.jpg)



![NH3 [Cu(NH3)]2+
NH3)]2+ + NH3 [Cu(NH
&
b
K K K K
4 1 2 3 4
K
f b =](https://image.slidesharecdn.com/3-140929013944-phpapp01/85/3-2-20-320.jpg)


![[Br-] =
Ksp
[Ag+]
=](https://image.slidesharecdn.com/3-140929013944-phpapp01/85/3-2-23-320.jpg)

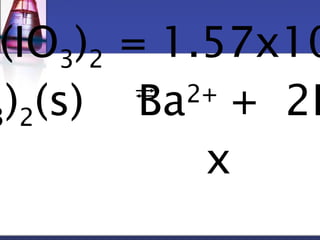
![[IO3
-]2 = 1.57x10-= 2[Ba2+]
Ba2+](2 [Ba2+])2 = 1.57x10-2x](https://image.slidesharecdn.com/3-140929013944-phpapp01/85/3-2-26-320.jpg)
![Ba2+] = (1.57x10-4
=7.32x10-](https://image.slidesharecdn.com/3-140929013944-phpapp01/85/3-2-27-320.jpg)

![A++ X- A2X 2A++X2-
2y y
X-] = Ksp [A+]2 [X2-] = Ksp
= Ksp [ 2y]2[y] = Ksp
4y3 = Ksp
= s = / 4 3 Ksp y= Ksp](https://image.slidesharecdn.com/3-140929013944-phpapp01/85/3-2-29-320.jpg)



![IO3
- ] รวม =
IO3
- ] excess
[IO3
- ]การละลา](https://image.slidesharecdn.com/3-140929013944-phpapp01/85/3-2-33-320.jpg)
![- ] จากการละลาย
[IO3
] = 0.0200 + 2[0.0200 M](https://image.slidesharecdn.com/3-140929013944-phpapp01/85/3-2-34-320.jpg)
![Ba2+] = s =Ksp
[IO3
- ]2
=1.57x10-9
(0.0200)2
=3.93x10-6 mol/](https://image.slidesharecdn.com/3-140929013944-phpapp01/85/3-2-35-320.jpg)
![ตย. คำานวณ
[H3O+] ใน
0.120 M HNO2
HNO2+H2O
HO++NO- K](https://image.slidesharecdn.com/3-140929013944-phpapp01/85/3-2-36-320.jpg)
![H+ > 1000
Ka
H3O+][NO2
-] = Ka
[HNO2]](https://image.slidesharecdn.com/3-140929013944-phpapp01/85/3-2-37-320.jpg)
![O+] = [NO2
-]
HNO2] = 0.120 -[H](https://image.slidesharecdn.com/3-140929013944-phpapp01/85/3-2-38-320.jpg)
![H3O+]2 = 5.1x10-0.120-[H3O+]](https://image.slidesharecdn.com/3-140929013944-phpapp01/85/3-2-39-320.jpg)
![[ H O
]
+ -
= ´
= ´ ´
+ -
-
H O Û H O +
OH
2 3
+ + =
x b b ac
a
ax bx c
2
4
0
7.8 10
0.120 5.1 10
2
2
3
4
3
= - ± -](https://image.slidesharecdn.com/3-140929013944-phpapp01/85/3-2-40-320.jpg)
![ตย. คำานวณ
[H3O+] ใน 2.
0x10-4 M
C6H5NH3C1(a](https://image.slidesharecdn.com/3-140929013944-phpapp01/85/3-2-41-320.jpg)
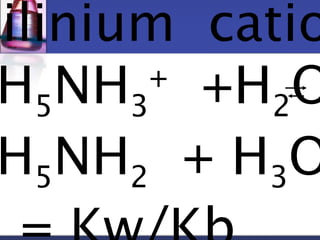
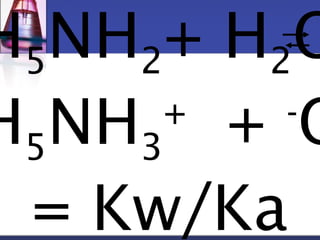
![H5NH3
+] =
2.0x10-4 -[H3O+]
/Ka <1000](https://image.slidesharecdn.com/3-140929013944-phpapp01/85/3-2-44-320.jpg)
![O+]2 = 2.54x10-2.0x10-4
ไม่ได้!
O+] = 7.1x10-](https://image.slidesharecdn.com/3-140929013944-phpapp01/85/3-2-45-320.jpg)
![[H3O+]2
2.0x10-4 -[H3O+]
2.54x10-5](https://image.slidesharecdn.com/3-140929013944-phpapp01/85/3-2-46-320.jpg)
![O+]2 +
2.54x10-5[H3O+]
5.08x10-9 = 0
O+] = 6.0x10-](https://image.slidesharecdn.com/3-140929013944-phpapp01/85/3-2-47-320.jpg)

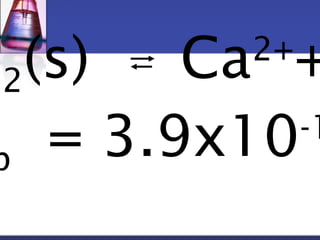
![2
K a a
sp Ca 2
+ F
-
Ca f F f
[ 2 + ] [ -
]
2 2
2
1 ( 0.0125 2 2 0.0125 2
2
)
2
0.0500
=
= ´ + ´
=
=
+ -
m
Ca f](https://image.slidesharecdn.com/3-140929013944-phpapp01/85/3-2-50-320.jpg)


![[ + ][ -
]
[ ]
K NH OH b
-
14
-
10
5
3
4
=
= ´
1.00 10
´
5.70 10
1.75 10
-
= ´
NH](https://image.slidesharecdn.com/3-140929013944-phpapp01/85/3-2-53-320.jpg)
![[ NH + ] =
[ -
OH
]
[ 4
NH +
] + [ NH ]
=
c
4 3
NH
3
=
0.0750
M
[NH ] = 0.0750
-
[ -
OH]
3](https://image.slidesharecdn.com/3-140929013944-phpapp01/85/3-2-54-320.jpg)
![[ ]
2
[ ]
2
[ ]
[ ] 3
5
2 2 5
- - -
» ´ ´ ´
7.50 10 1.75 10
1.15 10
1.75 10
7.50 10
OH
- -
-
- -
-
= ´
= ´
´ -
OH
OH
OH](https://image.slidesharecdn.com/3-140929013944-phpapp01/85/3-2-55-320.jpg)

![[ ] [ -
]
[ ]
K =
HOCl OH
K K
= = ´
1.00 10
7
-
14
8
8
w
b
3.33 10
3.0 10
3.0 10
-
-
-
-
= ´
´
= ´
a
b
K
OCl](https://image.slidesharecdn.com/3-140929013944-phpapp01/85/3-2-57-320.jpg)
![[ OH ] =
[ HOCl
]
[ OCl ] + [ HOCl
]
=
[ - ] 0.0100
[ -
]
0.0100
0.0100
»
= -
-
-
OCl OH](https://image.slidesharecdn.com/3-140929013944-phpapp01/85/3-2-58-320.jpg)
![[ ]
[ ]
[ ] 5
7
áá
2
= ´
3.33 10
5.8 10
-
OH
OH
0.0100
0.0100
- -
-
-
= ´
OH](https://image.slidesharecdn.com/3-140929013944-phpapp01/85/3-2-59-320.jpg)
