Estequiometria para alumnos
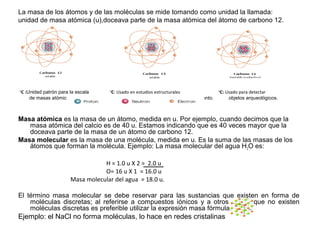
- 1. La masa de los átomos y de las moléculas se mide tomando como unidad la llamada: unidad de masa atómica (u),doceava parte de la masa atómica del átomo de carbono 12. 12 C :Unidad patrón para la escala 13 C: Usado en estudios estructurales 14 C: Usado para detectar de masas atómicas. de compuestos que contienen este elemento. objetos arqueológicos. Masa atómica es la masa de un átomo, medida en u. Por ejemplo, cuando decimos que la masa atómica del calcio es de 40 u. Estamos indicando que es 40 veces mayor que la doceava parte de la masa de un átomo de carbono 12. Masa molecular es la masa de una molécula, medida en u. Es la suma de las masas de los átomos que forman la molécula. Ejemplo: La masa molecular del agua H2O es: H = 1.0 u X 2 = 2.0 u O= 16 u X 1 = 16.0 u Masa molecular del agua = 18.0 u. El término masa molecular se debe reservar para las sustancias que existen en forma de moléculas discretas; al referirse a compuestos iónicos y a otros en los que no existen moléculas discretas es preferible utilizar la expresión masa fórmula. Ejemplo: el NaCl no forma moléculas, lo hace en redes cristalinas
- 3. Masa molecular- La masa molecular de un compuesto covalente es la masa, en unidades de masa atómica, de una molécula. Su masa molar es la masa, en gramos, de un mol de sus moléculas. La masa fórmula de un compuesto iónico es la masa, en unidades de masa atómica, de una unidad fórmula. Su masa molar es la masa, en gramos, de un mol de unidades fórmula. Etanol, C H OH, un compuesto covalente.₂ ₅ 2 átomos de carbono 2X 12.0 u = 24.00 u 6 átomos de hidrógeno 6X 1.00 u = 6.00 u 1 átomo de oxígeno 1X 16.0 u = 16.00 u masa molecular de C H OH 46.00 u.₂ ₅ Masa de un mol de moléculas de C H OH₂ ₅ = 46 g Masa molar del C H OH = 46.0 g/mol₂ ₅ Cloruro de calcio, CaCl , un compuesto iónico₂ 1 átomo de calcio 1X 40.1u = 40.1 u 2 átomos de cloro 2X 35.5u = 71.0 u masa fórmula del cloruro de calcio 111.1 u Masa de un mol de unidades fórmula de ,CaCl =₂ 111.1 g Masa molar del cloruro de calcio = 111.1 g/mol
- 4. ¿QUÉ PESA MÁS? UN MOL DE CLORURO DE POTASIO O UN MOL DE CLORURO DE SODIO?. KCl Cloruro de potasio, es un compuesto iónico 1 átomo de potasio 1X 39.0 u = 39.0 u 1 átomos de cloro 1X 35.5u = 35.5 u Masa fórmula del KCl 74.5 u Masa de un mol de unidades fórmula del KCl = 74.5 g Masa molar del kCl = 74.5 g/mol NaCl Cloruro de sodio, un compuesto iónico 1 átomo de sodio 1X 23.0 u = 23.0 u 1 átomo de cloro 1X 35.5 u = 35.5 u Masa fórmula del NaCl 58.5 u Masa de un mol de unidades fórmula del NaCl = 58.5 g Masa molar del NaCl = 58.5 g/mol Concluimos que pesa más un mol de cloruro de potasio que un mol de cloruro de sodio. 1 mol de KCl > 1 mol de NaCl en gramos en gramos 1 mol de KCl > 1 mol de NaCl en gramos en gramos Un mol de KCl Un mol de NaCl
- 5. MOL Mol, unidad básica del sistema internacional de unidades (SI), definida como la cantidad de una sustancia que contiene tantas entidades elementales (átomos, moléculas, iones, u otras partículas) como átomos hay en 0,012 kg (12 g) de carbono 12. Esa cantidad de partículas es aproximadamente de 6,0221 × 1023 , el llamado número de Avogadro. Por tanto, un mol es la cantidad de cualquier sustancia cuya masa expresada en gramos es numéricamente igual a la masa atómica de dicha sustancia. ESTEQUIOMETRÍA Cuando Lavoisier, en 1789, estableció lo que hoy se conoce como ley de la conservación de la materia sentó las bases para la estequiometría que la podemos definir como el procedimiento por medio del cual se determinan las cantidades de reactivos y productos que intervienen en una reacción química. Su etimología deriva del griego stoicheion que significa primer principio o elemento y metrón que significa medida.
- 6. Mol . El concepto de mol se ha generalizado como un número de partículas y es frecuente encontrar expresiones como: “un mol de átomos, “un mol de iones”, “un mol de moléculas”, etc. En todos los casos un mol contiene 6.02X1023 partículas: un mol de moléculas contiene 6.02X1023 moléculas, un mol de iones contiene 6.02X1023 iones etc. Al número se le conoce como número de Avogadro Ejercicio1. Completa la tabla con lo que a continuación se te pide: ¿Cuántas moléculas existen en 2 moles de oxígeno, 3 moles de agua, 0.5 moles de NH₃ y en 100 moles de NaCl ? Sustancia Número de moles Número de moléculas O₂ 2 H₂O 3 NH₃ 0.5 NaCl 100 6.02X1023 6.02X1023 18.06X10²³ 12.04X10²³ 3.01X10²³ 6.02X10²⁵
- 7. Ejercicio 2. Completar el siguiente cuadro: Ejercicio 3.Completar el siguiente cuadro: Sustancia Fórmula Masa molar en ( g/mol) Masa de 1 mol Masa de 5 mol Masa de 0.1 mol Hidrógeno H₂ Amoniaco NH₃ Clorato de sodio NaClO₃ Ácido nítrico HNO₃ 2 17 106.5 63 2 g 17 g 106.5 g 63 g 10 g 85 g 532.5 g 315 g 0.2 g 1.7 g 10.65 g 6.3 g Sustancia Fórmula Masa molecular N° de moles Masa en gramos Oxígeno O₂ 3 Ácido sulfhídrico H₂S 68.0 g Cloro Cl₂ 35.5 g Hidróxido de calcio Ca(OH)₂ 0.4 32 34 71 74 2 0.5 96.0 g 29.5 g
- 8. Estequiometría. Se denomina estequiometría al estudio de las reacciones cuantitativas que existen entre las sustancias que intervienen en las reacciones químicas. Pasos fundamentales en la resolución de problemas de estequiometría: a) Escribir la ecuación química. b) Balancearla. c) A partir de la reacción balanceada, calcular las masas, moles o moléculas de las sustancias que se mencionan en al problema. Ejemplo: a)Se escribe la ecuación química: N + H NH₂ ₂ ₃ b)Balancearla: N₂ + 3 H₂ 2NH₃ c)La masa en gramos de cada una de las sustancias que intervienen en la reacción química se puede calcular de la siguiente manera: n = masa Donde n = número de moles masa molar Despejando tenemos: masa (g) = n (moles) X masa molar (g/mol)
- 9. Ejercicio4. En la siguiente reacción, indicar la masa en gramos de cada una de las sustancias. N₂ + 3H₂ 2NH₃ Sustancia N° de moles Masa molar g/mol Calculos moles X masa molar Masa total N₂ 1mol X 28g/mol H₂ 3mol X 2g/mol NH₃ 2mol X 17 g/mol
- 10. • Ley de Proust. “Cuando dos o más elementos se unen para formar un compuesto, la relación en masa en que lo hacen es siempre la misma” Ejercicio 5. Calcular la composición en % (centesimal) de las sustancias que se indican en la tabla, llenando los espacios correspondientes, utiliza la siguiente fórmula: % elemento = masa del elemento X100 masa del compuesto Proust observó que el agua está formada siempre por 11 partes por 100 de hidrógeno y por 89 partes por 100 de oxígeno, sea cual sea su procedencia. En la molécula de agua hay 11 % de Hidrógeno y 89 % de Oxígeno. Joseph proust Compuesto Elemento Cálculo % Resultado Suma de % H₂O H 2/18 X100 11.11 % O 16/18X100 88.89 % 100 % H₂SO₄ H S O 100 % NaOH Na O H 100 % KClO₃ K Cl O 100 % 2/98X100 2.04 % 32/98X100 32.65 % 64/98X100 65.31% 23/40X100 57.5 % 16/40X100 40.0 % 1/40X100 2.5 % 39/122.5X100 31.84 % 35.5/122.5X100 28.98 % 48/122.5X100 39.18 %
- 11. PROBLEMAS DE ESTEQUIOMETRÍA La estequiometría es utilizada para saber cuánto producto se formará a partir de cierta cantidad de reactivo ó que cantidad de reactivo se necesita para obtener una cantidad “x” de producto; es por ello que se realizan cálculos estequiométricos. Se pueden hacer conversiones estequiométricas masa – masa ó mol – mol dependiendo de lo que se solicite. Estequiometría masa – masa: este proceso se utiliza cuando se necesita conocer la cantidad de cada reactivo que se debe utilizar para producir la masa del producto que se desee. Por ejemplo, en la relación masa - masa. Sí se cuenta con 980 g de FeCl3 para realizar la siguiente reacción Química: FeCl3 + NaOH Fe(OH)3 + NaCl ¿Cuántos gramos de Fe(OH)3 se producirán?
- 12. Se balancea la ecuación FeCl3 + NaOH Fe(OH)3 + NaCl
- 13. Reactivos N° de átomos Elementos Productos N° de átomos 1 Fe 1 3 Cl 3 3 Na 3 3 H 3 3 O 3 REACTIVOS PRODUCTOS FeCl3 1 átomo de Fe 1X55.85g = 55.85u 3 átomos de Cl 3X35.45g = 106.35u masa molar= 162.20g/mol Fe(OH)3 1 átomo de Fe 1X55.85 = 55.85 u 3 átomos de O 3X16 = 48.0 u 3 átomos de H 3X1 = 3 .0 u masa molar =106.85 g/ mol 3NaOH 3 átomos de Na 3X23g = 69 u 3 átomos de O 3X16g = 48 u 3 átomos de H 3X 1g = 3 u masa molar=120 g/mol 3NaCl 3 átomos de NaCl 3X23 g = 69.0 u 3 átomos de Cl 3X35.45g = 106.35u masa molar= 175.35g/mol Se realizan cálculos de las masas molares de cada uno de los reactivos y productos. FeCl3 + 3NaOH Fe(OH)3 + 3NaCl
- 14. Se realizan los cálculos correspondientes : FeCl3 + 3NaOH Fe(OH)3 + 3NaCl 162.20g 106.85g 980g X X = (980g FeCl3) (106.85g Fe(OH)3) = 645.58g de FeCl3 162.20 g FeCl3 Relación mol – mol. En esta relación, entonces se aplica el concepto de mol a la ecuación química balanceada de la siguiente manera: FeCl3 + 3NaOH Fe(OH)3 + 3NaCl 1 mol de FeCl3 + 3 moles de NaOH 1 mol de Fe(OH)3 + 3 moles de NaCl sí se adicionan 5 moles de FeCl3 en la reacción química, ¿Cuántos moles de NaCl se obtendrán? FeCl3 + 3NaOH Fe(OH)3 + 3NaCl 1 mol 3 mol 5 mol X X = ( 5moles FeCl3 ) ( 3 moles NaCl) = 15 moles de NaCl 1mol FeCl3 Se producirán 15 moles de NaCl