Reacciones químicas
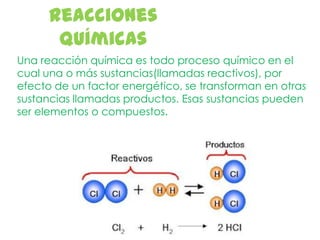
- 1. Reacciones Químicas Una reacción química es todo proceso químico en el cual una o más sustancias(llamadas reactivos), por efecto de un factor energético, se transforman en otras sustancias llamadas productos. Esas sustancias pueden ser elementos o compuestos.
- 2. 1. Reacción de Combinación cualquier sustancia A+B-----AB: A y B representan química. COMPUESTO IÓNICO METAL+NO ión positivo + ión negativo METAL Ejemplos: Na+Cl 2 NaCl Cr + Br2 CrBr2 K + S8 K2 S
- 3. RECUERD A! • Los elementos diatómicos: nitrógeno, oxígeno, flúor, cloro, bromo, iodo. • Sulfuro= S4 • Ozono= O3 • Fósforo= P4 • Arsénico= As4
- 4. COMPUESTO NO METAL + NO METAL BINARIO ENTRE 2 NO METALES Elemento más electronegativo número de oxidación negativo Elemento menos electronegativo número de oxidación positivo H2+O2 H2O EJEMPLOS B+O2 B2O3 S8+I2 SI2 C+Cl2 CCL4
- 5. COMBINACIÓN ELEMENTO + COMPUESTO Cuando un elemento puede presentar varios estados de oxidación positivos, al combinarse con un elemento más electronegativo podrá originar primero un compuesto en donde presenta el estado de oxidación positivo más bajo Mn + O2 MnO
- 6. Si este compuesto se combina con el mismo elemento formará compuestos en donde presentará estados de oxidación positivos superiores. EJEMPLO: MnO + O2 Mn2O3 Mn2O3 + O2 MnO2 MnO2 + O2 MnO3 MnO3 + O2 Mn2O7 C + O2 CO CO + O2 CO2 CO2 + O2 NO REACCIONA! (Carbón no tiene más valencias positivas)
- 7. COMBINACIÓN DE DOS COMPUESTOS Dos Tipos: 1. Óxido Metálico + Agua Hidróxido OM + H2O MOH Ejemplos Li2O + H20 LiOH FeO + H2O Fe (OH)2 H2O + MgO Mg (OH)2 Al2O3 + H2O Al (OH)3
- 8. 2. Óxido No Metálico + Agua Oxácido ONM + H2O Ejemplos: . P2O5 + H2O H3PO4: ácido fosfórico Cl2O7 + H2O HCLO4: ácido clorítico CO2 + H2O H2CO3: ácido carbónico SO3 + H2O H2SO4 : ácido sulfúrico
- 9. 2.Reacción de Descomposición A----B+C Podemos clasificarlas en 3 categorías. 1. Descomposición de un compuesto en dos elementos 2. Descomposición de un compuesto en un compuesto y un elemento. 3. Descomposición de un compuesto en dos compuestos.
- 10. Descomposición de un compuesto en 2 elementos • Se descompone totalmente en los dos elementos que lo constituyen. EJEMPLOS: Agua : H2+O2 H2O Amoniaco : N2 + H2 NH3 Cloruro de Hierro (III): Fe + Cl2 FeCl3 Nitruro de Sodio: N2 + Na Na3N
- 11. Descomposición de un compuesto en un compuesto y un elemento • EJEMPLOS: SO3 SO2 + O2 SO2 S8 + O2 N2O5 N2O3 + O2 N2O3 N2 + O2 SF6 SF4 + F2 SF4 SF2 + F2 SF2 S8 + F2
- 12. Descomposición de un Compuesto en Dos Compuestos 1. Descomposición de hidróxidos Cuando se descompone un hidróxido nos da el óxido metálico correspondiente más agua. 2. Descomposición de oxácidos. Cuando se descompone un oxácido nos da el óxido no metálico correspondiente más agua.
- 13. 1. Descomposición de hidróxidos
- 14. Descomposición de oxácidos H3PO4 P2O5 + H2O HClO4 Cl2O7 + H2O H2CO3 CO2 + H2O HNO3 NO5 + H2O H2SO4 SO3 + H2O HNO2 N2O3 + H2O HClO Cl2O + H2O HIO4 I2O7 + H2O
- 15. 3. Reacción de Desplazamiento ORDEN DE REACTIVIDAD DE LOS METALES Li, Rb, K, Ba, Ca, Na, Mg, Al, Mn, Zn, Fe, Ni, Sn,Pb, H, Cu, Ag, Hg, Pt, Au.
- 17. 4.Doble Desplazamiento Dos sustancias constituidas por un componente positivo y uno negativo reaccionan. Al combinarse o producirse la reacción el componente positivo de cada sustancia se combina con el negativo de la otra. Ax + By Ay + Bx AgNO3 + KCl KNO3 + AgCl LiBrO3 + K3PO4 Li3PO4 + KBrO3 Fe2S3 + HCl FeCl3 + H2S
- 18. 5.Neutralización Ácido Base una sal Ácido reacciona con una base se produce más agua. EJEMPLOS: -HCl + Mg(OH)2 MgCl2 + H2O -HCl + Al (OH)3 AlCl3 + H2O -H2SO4 + Al (OH)3 Al2(SO4)3 + H2O -H3PO4 + KOH K3(PO4) + H2O
- 19. 6.Combustión •Aquí una sustancia se quema en presencia de oxígeno (o sea reacciona con el oxígeno). La combustión completa de un elemento usualmente da como resultado el óxido del elemento en su estado de oxidación más alto. Fe + O2 Fe2O3 Na + O2 Na2O Cr + O2 Cr2O6 = CrO3 •Al quemar un compuesto generalmente se producen óxidos de los elementos presentes en su estado de oxidación más elevados. FeS2 + O2 Fe2O3 + SO3 Ca2C + O2 CaO + CO2 CH4 + O2 CO2 + H2O PH3 + O2 P2O5 + H2O
- 20. • Cuando los elementos nitrógeno, flúor, cloro, bromo y yodo están presentes en la sustancia original generalmente son convertidos en elementos libres y no en óxidos. NH3 + O2 N2 + H 2 O SBr4 + O2 SO3 + Br2 CCl4 + O2 CO2 + Cl2 CH2N + O2 CO2 + H2O + N2