Configuración electrónica de los elementos químicos
•Download as PPT, PDF•
14 likes•35,353 views
Este documento explica las reglas para escribir la configuración electrónica de los átomos. Los electrones se distribuyen en 7 niveles de energía y subniveles s, p, d y f. Cada orbital puede contener hasta 2 electrones y se llenan por orden de energía creciente. El documento provee un ejemplo de cómo aplicar estas reglas para escribir la configuración electrónica del calcio.
Report
Share
Report
Share
Recommended
Clase 4 teoria atomica iii tabla periodica y propiedades periodicas.unlocked

Clase 4 teoria atomica iii tabla periodica y propiedades periodicas.unlockedUniversidad Pedro de Valdivia
More Related Content
What's hot
Clase 4 teoria atomica iii tabla periodica y propiedades periodicas.unlocked

Clase 4 teoria atomica iii tabla periodica y propiedades periodicas.unlockedUniversidad Pedro de Valdivia
What's hot (20)
2.6. Elementos de transición interna o tierras raras.pptx

2.6. Elementos de transición interna o tierras raras.pptx
Clase 4 teoria atomica iii tabla periodica y propiedades periodicas.unlocked

Clase 4 teoria atomica iii tabla periodica y propiedades periodicas.unlocked
Similar to Configuración electrónica de los elementos químicos
Similar to Configuración electrónica de los elementos químicos (20)
Ppt configuracionelectronicadeloselementosquimicos

Ppt configuracionelectronicadeloselementosquimicos
Configuracionelectronicaexcelente 140330133112-phpapp01

Configuracionelectronicaexcelente 140330133112-phpapp01
Configuracionelectronicaexcelente 140330133112-phpapp01

Configuracionelectronicaexcelente 140330133112-phpapp01
CONFIGURACION ELECTRONICA. ciencias físico Naturales pptx

CONFIGURACION ELECTRONICA. ciencias físico Naturales pptx
More from Nora Besso
More from Nora Besso (20)
Proyecto de Investigación en Ciencias Naturales- Eje1- Continuación

Proyecto de Investigación en Ciencias Naturales- Eje1- Continuación
Reacciones químicas: reactivos, productos, moles, masa molar, número de Avoga...

Reacciones químicas: reactivos, productos, moles, masa molar, número de Avoga...
Derrame de petróleo: Material auxiliar para interpretar los resultados del pr...

Derrame de petróleo: Material auxiliar para interpretar los resultados del pr...
Herencia monogénica- Dominancia completa: selección de problemas

Herencia monogénica- Dominancia completa: selección de problemas
Recently uploaded
Centros Multigrados Procedimientos para la planificación en los Centros Educativos tipo V ( multi...

Procedimientos para la planificación en los Centros Educativos tipo V ( multi...Katherine Concepcion Gonzalez
Recently uploaded (20)
Procedimientos para la planificación en los Centros Educativos tipo V ( multi...

Procedimientos para la planificación en los Centros Educativos tipo V ( multi...
PINTURA DEL RENACIMIENTO EN ESPAÑA (SIGLO XVI).ppt

PINTURA DEL RENACIMIENTO EN ESPAÑA (SIGLO XVI).ppt
Prueba de evaluación Geografía e Historia Comunidad de Madrid 4ºESO

Prueba de evaluación Geografía e Historia Comunidad de Madrid 4ºESO
ACRÓNIMO DE PARÍS PARA SU OLIMPIADA 2024. Por JAVIER SOLIS NOYOLA

ACRÓNIMO DE PARÍS PARA SU OLIMPIADA 2024. Por JAVIER SOLIS NOYOLA
Tema 10. Dinámica y funciones de la Atmosfera 2024

Tema 10. Dinámica y funciones de la Atmosfera 2024
2 REGLAMENTO RM 0912-2024 DE MODALIDADES DE GRADUACIÓN_.pptx

2 REGLAMENTO RM 0912-2024 DE MODALIDADES DE GRADUACIÓN_.pptx
Configuración electrónica de los elementos químicos
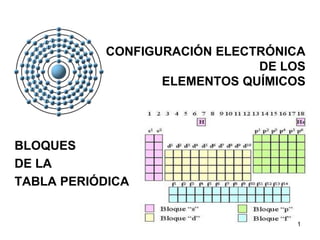
- 1. CONFIGURACIÓN ELECTRÓNICA DE LOS ELEMENTOS QUÍMICOS BLOQUES DE LA TABLA PERIÓDICA 1
- 2. Clasificación de los elementos químicos Según: • Origen • Estado de agregación • Pertenencia a Grupos especiales • Propiedades 2
- 3. Otro criterio de clasificación Según: • CONFIGURACIÓN ELECTRÓNICA 3
- 4. Configuración electrónica: Definición • Ordenamiento de los electrones en la corteza del átomo neutro. 4
- 5. Configuración electrónica REGLAS 5
- 6. Configuración electrónica: 1º Regla- Niveles de energía Existen 7 niveles de energía (n, niveles de energía de Bohr) o capas donde pueden situarse los electrones, numerados del 1 al 7. 1 2 3 4 5 6 7 6
- 7. Configuración electrónica: 2º Regla- Subniveles Cada nivel tiene sus electrones distribuídos en distintos subniveles, que pueden ser de cuatro tipos: s, p, d, f. 7
- 8. 2º Regla: Subniveles 1 2 3 4 5 6 7 s sp spd spdf spdf spd sp 8
- 9. Configuración electrónica: 3º Regla- Orbitales/ Subnivel Subnivel Orbitales s 1 p 3 d 5 f 7 9
- 10. 3º Regla: Orbitales 1 2 3 4 5 6 7 1 1,3 1,3,5 1,3,5,7 1,3,5,7 1,3,5 1,3 10
- 11. 3º Regla: Electrones / Subnivel Cada orbital puede contener hasta 2 electrones!!!!!!!!!!!!!!!!!! 11
- 12. 3º Regla: Electrones / Subnivel 1 2 3 4 5 6 7 1 1,3 1,3,5 1,3,5,7 1,3,5,7 1,3,5 1,3 2 2,6 2,6,10 2,6,10,14 2,6 2,6,10,14 2,6,10 12
- 13. 3º Regla: Electrones / Nivel 1 2 3 4 5 6 7 1 1,3 1,3,5 1,3,5,7 1,3,5,7 1,3,5 1,3 2 2,6 2,6,10 2,6,10,14 2,6,10,14 2,6,10 2,6 2 8 18 32 32 18 8 13
- 14. RESUMIENDO… 14
- 15. Para escribir la Configuración Electrónica (C.E.) de cualquier átomo…. • Debo saber cuántos electrones posee. • Formas de saber la cantidad de electrones: Z Grupo y Período A y neutrones 15
- 16. ¿CÓMO SE UBICAN LOS ELECTRONES? • Los electrones se van situando en los diferentes niveles y subniveles por orden de energía creciente hasta completarlos. • Se llena cada nivel y subnivel antes de colocar electrones en el nivel siguiente. 16
- 17. El orden de llenado de los orbitales es el siguiente: 1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d 7p 17
- 18. Otra vez…. 18
- 19. EJERCICIO Escribir la C. E. de un átomo del elemento Ca: CE Ca: 1s 2s 2p 3s 3p 4s 19
- 20. COLUMNA DENTRO DEL BLOQUE PERÍODO BLOQUE DE LA TABLA PERIÓDICA 20
- 21. Bloques de la T. P. 21
