2.13 enlaces y fuerzas intermoleculares
- 2. Átomos Estables • ¿Por que los átomos forman compuestos enlazándose con otros átomos? • Todo en el universo busca los estados mas estables. Para los átomos la máxima estabilidad es tener sus subniveles s y p completos. • Algunos átomos ganan e- y otros pierden para tener estructuras mas estables
- 3. Electrones de valencia • Son los electrones del mayor nivel de energía • En base a estos electrones, la regla del octeto determina e- puede ganar o perder el átomo.
- 4. Regla del Octeto • La regla del octeto es la tendencia de los átomos a tener una configuración electrónica similar a los gases nobles. • Con excepción de He los gases nobles tienen 8 electrones en su ultimo nivel de energía
- 5. Introducción • Enlaces químicos –Son la fuerza que mantiene a los átomos juntos en una molécula.
- 6. Introducción Enlaces químicos –En general los electrones se pueden ganar, perder o compartir entre átomos.
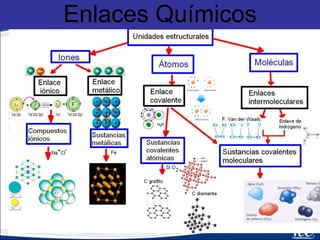
- 8. Enlaces • Enlaces Intramoleculares: Enlaces dentro de la molécula: – Iónico – Covalente – Metálico
- 9. Enlaces Iónicos • Trasferencia de electrones (formación de iones) • Metal con un No metal • La diferencia de electronegatividad es mayor 1.7 • En solución conducen la electricidad
- 10. Enlace Iónico • Se da entre un metal y no metal • La diferencia de electronegatividad debe ser 1.7 o mayor
- 11. Cuando se forma un enlace iónico, el elemento metálico pierde electrones y en no metal gana teniendo 8 electrones en su ultimo nivel.
- 12. Los no metales ganan electrones: Este proceso es llamado reducción. :Cl. + 1e- :Cl: - 1 Ion Cloruro :O: + 2e- :O: -2 Ion Oxido :N. + 3e- :N: -3 Ion nitruro Formación de aniones
- 13. Los metales pierden electrones formando cationes: Al proceso de perder electrones se le llama oxidación. Na. Na+ + e- Mg: Mg2+ + 2 e- :Al. Al 3+ + 3 e- Formación de cationes
- 14. Cuando los compuestos iónicos están disueltos en agua, se disocian formados una solución con iones: NaCl(s) Na+(aq) + Cl-(aq) Como resultado conducen la corriente eléctrica y son llamados electrolitos. Compuestos Iónicos en solución H2O
- 15. Covalentes • Covalente NO Polar – Los e- se comparte simétricamente - Diferencia de electronegativa es menor a 0.4 • Covalente Polar – Los electro e- se comparten de modo asimétrico – La diferencia de electronegatividad es menor a 1.7
- 16. Enlace Covalente • Se comparten electrones • Es la unión de un no metal con un no metal • No conducen la corriente eléctrica – Enlaces no polares: Entre átomos cuya diferencia de electronegatividad es menos 0.4 – Enlaces polares : Entre átomos cuya diferencia de electronegatividad esta entre 0.4 y 1.7
- 17. Enlaces Covalentes Polar y No Polar H-H es no-polar por que la diferencia de electronegatividad es 0. Cl-Cl es no-polar. H-Cl es polar por que existe una diferencia de electronegatividad pero menor a 1.7 ( H = 2.1, Cl = 3.0 )
- 19. Enlace Metálico • Es la unión de un metal con un no metal • Están unidos por electrones en movimiento (mar de electrones ) • Buenos conductores del calor y electricidad
- 20. Tipo de enlace Tipo de elementos (metal, no metal) Diferencia de electronegatividad Comportamiento electrónico. (Gana, pierde, comparte, se mueve libremente) Solubilidad (Agua, solventes polares, solventes no polares) Punto de Fusión (Alto, Medio, Bajo) Estado de Agregación (Solido, Liquido, Gaseoso) Conducción de calor y electricidad Iónico Sal NaCl Covalente (no polar) H2, O2, NO2 Covalente (polar) Glucosa C6H12O6 Metálico Monedas (Cobre, aluminio Níquel), Bronce (mezcla cobre y estaño) NO APLICA
- 21. Tipos de Enlace y estados de la materia • Gases: – Casi todos son monoatómicos(He, Ar) o tienen enlaces covalentes no polares entre ellos(N2, CO2) • Líquidos: – Los líquidos suelen tener enlaces covalentes, excepto por Br y Hg, que son líquidos a temperatura ambiente. – Los líquidos polares son miscibles entre si, los no polares son miscibles entre si(similar disuelve lo similar) • Solidos: – Los compuestos iónicos conducen electricidad en solución. – Todos los metales son sólidos a temperatura ambiente (esto se debe al enlace metálico), excepto Hg.
- 23. Estructuras de Lewis Solo aplica para elementos representativos
- 24. Simbología punto electrón 24 Los electrones del ultimo nivel son representados con un punto Los electrones de Valencia se acodan alrededor del símbolo del elemento. Mg tiene 2 electrones de Valencia. Pueden tener muchas representaciones Mg Mg Mg Mg Mg
- 25. Lewis estructuras El átomo es representado con su símbolo rodeado por sus electrones de Valencia en forma de puntos Pasos 1. Escribir la configuración electrónica. 2. Identificar los e- de valencia. 3. Dibujar los electrones de valencia alrededor del símbolo. – En cada lado (arriba, abajo, derecha, izquierda) se colocan máximo dos e- – Primero se llena cada lado con un electrón y luego se forman pares
- 26. Ejemplo: Hidrógeno Primero se determina la configuración electrónica del elemento que se desea representar. En el caso del hidrógeno será: 1H = 1S1 Número solo tiene un electrón atómico de valencia. • Se identifica el número de electrones del último nivel.
- 27. Figura de Lewis Los electrones de valencia se dibujan alrededor del símbolo del elemento Símbolo del Unico electrón hidrógeno de valencia H *
- 28. Estructura de Lewis Configuración electrónica: 5B=1s22s22p1 Ultimo nivel de energía Electrones de valencia Primero se coloca Un e- , si hubiera mas De 4 e- entonces se empieza a formar parejas * B
- 29. Estructura de Lewis Configuración electrónica: 8O=1s22s22p4 O* ** * * * Numero de electrones de valencia = 7 Máximo nivel de energía
- 30. Bromo Configuración Electrónica 35 Br =1s22s22p63s23p64s23d104p5 Br Numero de electrones de valencia = 7 Máximo nivel de energía * ** ** **
- 31. Los elementos de una familia los mismos e- de valencia y sus figuras de Lewis son iguales
- 32. Elemento Configuración electrónica e- Valencia Diagrama Lewis Predicción de e- a ganar o perder 16 S 20 Ca 27 Co 35 Br
- 33. Estructuras de Lewis para moléculas 1. Dibuje la figura de Lewis para cada elemento(Use puntos para un elemento y cruces para el otro) 2. Coloque a los átomos en orden lógico. Recuerde que el mas electronegativo es negativo y el otro positivo 3. Distribuya los electrones para cumplir el octeto F O F
- 34. Estructuras de Lewis para Moléculas • Para figuras iónicas el electrón se dibuja en el átomo al que es trasferido • Para un compuesto covalente se puede dibujar como línea F F F ─ F Na O Na
- 36. Investiga (1 de 2) ¿Cuál es la diferencia entre enlaces intramoleculares y las fuerzas intermoleculares (Como las fuerzas de dipolo - dipolo) ¿Qué tipos de fuerzas intermoleculares existen y como afectan al estado de agregación de las sustancias?
- 37. Investiga (2 de 2) ¿Como las fuerzas intermoleculares intervienen en las propiedades de las sustancias? Define “el puente de hidrogeno” Define los siguientes tipos de fuerza intermoleculares:(Fuerzas de Van der Waals) Fuerzas Dipolo - Dipolo Fuerzas de dispersión de London
- 38. • Fuerzas Intermolecular: Crean interrelación entre dos o mas moléculas: – Puente de Hidrogeno: Hidrogeno: F,N y O -Fuerzas de Van der Waals • Dipolo-Dipolo (Covalentes Polares) • Dispersión de London (Covalentes no polares)
- 39. • Puentes de hidrogeno: – Se Forman cuando el hidrogeno esta unido a elementos muy electronegativos: Flúor, Oxigeno y Nitrógeno – Son muy fuetes y crean “redes” – Ejemplos: HF, H2O, NH3
- 40. • Fuerzas Dipolo- Dipolo: – Suceden en moléculas polares – El polo positivo de una molécula arte al polo positivo de otra – Son medianamente fuertes – Ejemplos: HCl, H2S, SO2
- 41. • Fuerzas de dispersión de London – Suceden en moléculas no polares – Fuerza es débil – Los “polos” en estas moléculas son intermitentes
- 44. Iónicos Conduce Electricidad En solución Alto Punto Fisión No Conduce electricidad Y calor solido Estado de agregación Solubilidad
- 45. Covalentes NO Polar NO2 Tipo de átomos Comportamiento Electrónico Diferencia electronegatividad Estado Agregacion
- 46. Covalentes NO Polar Bajos puntos fusión Solubilidad No conduce Calor ni electricidad
- 47. COVALENTE POLAR Estados de Agregación
- 48. Bajo punto fusión No Conduce Calor Ni Electricidad Solubilidad Comportamiento electronico
- 49. Enlace Metálico Comportamiento electrónico Estado de agregación Elementos que lo forman
- 50. Enlace Metálico Solubilidad Punto de fusión Conducción Calor y electricidad
- 53. Enlaces: Fuerzas Intramoleculares Mantienen unidos átomos Dentro de una molécula N-H O-H Fuerzas Intermoleculares A las moléculas entre si H2O -----H2O NH3 ---- H2O HCl ---- HCl
- 54. Las fuerzas intermoleculares tienen una gran importancia: Estados de agregación: punto de fusión , punto de ebullición, etc Propiedades físicas: Cohesión, adhesión, viscosidad, densidad, tensión superficial, etc
- 55. • Fuerzas Intermolecular: Crean interrelación entre dos o mas moléculas: – Puente de Hidrogeno: Hidrogeno: F,N y O -Fuerzas de Van der Waals • Dipolo-Dipolo (Covalentes Polares) • Dispersión de London (Covalentes no polares)
- 56. Puentes de Hidrogeno Elementos muy electronegativos HF, H2O, NH3
- 57. Covalentes polares y Iónicas Dipolo - Dipolo
- 58. Covalentes no polares Fuerzas de dispersión de London
