Fuerzasintermoleculares 090807204700-phpapp01
•Download as PPT, PDF•
2 likes•1,893 views
Report
Share
Report
Share
More Related Content
What's hot
What's hot (20)
Similar to Fuerzasintermoleculares 090807204700-phpapp01
Similar to Fuerzasintermoleculares 090807204700-phpapp01 (20)
PRESENTACIÓN DE FUERZAS INTERMOLECULARES 2021A.pptx

PRESENTACIÓN DE FUERZAS INTERMOLECULARES 2021A.pptx
Trabajo de Jessenia y Angie: Enlace Intermolecular

Trabajo de Jessenia y Angie: Enlace Intermolecular
Recently uploaded
Recently uploaded (20)
Presentación inteligencia artificial en la actualidad

Presentación inteligencia artificial en la actualidad
El_Blog_como_herramienta_de_publicacion_y_consulta_de_investigacion.pptx

El_Blog_como_herramienta_de_publicacion_y_consulta_de_investigacion.pptx
Google-Meet-como-herramienta-para-realizar-reuniones-virtuales.pptx

Google-Meet-como-herramienta-para-realizar-reuniones-virtuales.pptx
LAS_TIC_COMO_HERRAMIENTAS_EN_LA_INVESTIGACIÓN.pptx

LAS_TIC_COMO_HERRAMIENTAS_EN_LA_INVESTIGACIÓN.pptx
Explorando la historia y funcionamiento de la memoria ram

Explorando la historia y funcionamiento de la memoria ram
Segunda ley de la termodinámica TERMODINAMICA.pptx

Segunda ley de la termodinámica TERMODINAMICA.pptx
La Electricidad Y La Electrónica Trabajo Tecnología.pdf

La Electricidad Y La Electrónica Trabajo Tecnología.pdf
El uso de las tic en la vida ,lo importante que son

El uso de las tic en la vida ,lo importante que son
Crear un recurso multimedia. Maricela_Ponce_DomingoM1S3AI6-1.pptx

Crear un recurso multimedia. Maricela_Ponce_DomingoM1S3AI6-1.pptx
Hernandez_Hernandez_Practica web de la sesion 11.pptx

Hernandez_Hernandez_Practica web de la sesion 11.pptx
Fuerzasintermoleculares 090807204700-phpapp01
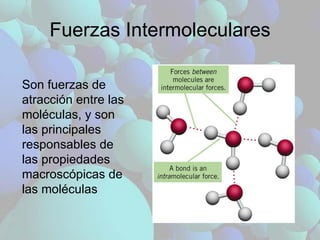
- 1. Fuerzas Intermoleculares Son fuerzas de atracción entre las moléculas, y son las principales responsables de las propiedades macroscópicas de las moléculas
- 8. Las moléculas polares tienen mayor punto de ebullición, ya que cuesta más separar una molécula de otra
- 16. El enlace de Hidrógeno es responsable del elevado punto de ebullición del agua
- 17. Enlace de Hidrógeno Se simboliza mediante una línea de puntos. Es más fuerte cuando forma una línea recta con los átomos involucrados
- 21. Energías de los enlaces
- 24. Consecuencias
