27624568 teoria-da-ligacao-de-valencia
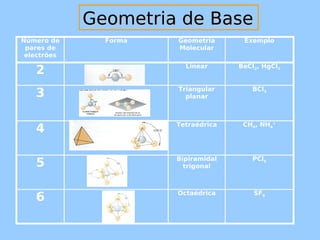
- 1. GGeeoommeettrriiaa ddee BBaassee Número de pares de electrões Forma Geometria Molecular Exemplo 2 Linear BeCl2, HgCl2 3 Triangular BCl3 planar 4 Tetraédrica CH4, NH4 + 5 Bipiramidal trigonal PCl5 6 Octaédrica SF6
- 2. Formas moleculares ccoomm 44 ppaarreess ddee eelleeccttrrõõeess eemm vvoollttaa ddoo ááttoommoo cceennttrraall Pares electrões em ligações Pares electrões não ligantes Estrutura Geometria 4 0 Tetraédrica; todos os ângulos 109.5º 3 1 Piramidal trigonal (Ex: NH3) 2 2 Ângular (Ex: H2O)
- 3. Mecânica quântica e ligação covalente FFaallhhaa nnaa tteeoorriiaa ddaa lliiggaaççããoo ddee LLeewwiiss:: ddeessccrreevvee aa lliiggaaççããoo qquuíímmiiccaa ccoommoo oo eemmppaarreellhhaammeennttoo ddee ddooiiss eelleeccttrrõõeess nnããoo jjuussttiiffiiccaannddoo aass ddiiffeerreennççaass nnooss ccoommpprriimmeennttooss ddee lliiggaaççããoo ee nnaass eenneerrggiiaass ddee ddiissssoocciiaaççããoo;; eexx:: HH--HH,, 744 ppmm,, 443366,,44 KKJJ//mmooll;; FF--FF,, 114422 ppmm,, 114422 KKJJ//mmooll EExxiisstteemm 22 tteeoorriiaass sseemmeellhhaanntteess,, bbaasseeaaddaass nnaa MMeeccâânniiccaa QQuuâânnttiiccaa,, qquuee sseerrvveemm ppaarraa ddeessccrreevveerr aa ffoorrmmaaççããoo ddee lliiggaaççõõeess ccoovvaalleenntteess ee aa eessttrruuttuurraa eelleeccttrróónniiccaa ddaass mmoollééccuullaass:: TTeeoorriiaa ddoo EEnnllaaccee ddaa VVaallêênncciiaa:: ppoossttuullaa qquuee ooss eelleeccttrrõõeess nnuummaa mmoollééccuullaa ooccuuppaamm oorrbbiittaaiiss aattóómmiiccaass ddooss ááttoommooss iinnddiivviidduuaaiiss ffoorrmmaannddoo--ssee aa lliiggaaççããoo qquuaannddoo eessttaass ssee ssoobbrreeppõõeemm;; TTeeoorriiaa ddaass OOrrbbiittaaiiss MMoolleeccuullaarreess:: pprreessssuuppõõee aa ffoorrmmaaççããoo ddee oorrbbiittaaiiss mmoolleeccuullaarreess aa ppaarrttiirr ddaass oorrbbiittaaiiss aattóómmiiccaass..
- 4. Teorias da Ligação (TLV) TEORIA DA LIGAÇÃO de VALÊNCIA—Linus Pauling • Electrões de valência estão localizados entre os átomos (ou são pares isolados). • Orbitais atómicas semipreenchidas sobrepõem-se para formar ligações.
- 5. Teoria da Ligação de Valência O modelo da RPECV baseado nas estruturas de Lewis não permite explicar a formação de ligações químicas! Não explica porque a ligação F-F é mais fraca que a ligação H-H, apesar da partilha de um par de electrões. Segundo a TLV a formação da ligação covalente H-H resulta da sobreposição espacial (ou coalescência) de duas orbitais 1s dos átomos.
- 6. Teoria ddoo EEnnllaaccee ddaa VVaallêênncciiaa Formação da molécula de hidrogénio: A ligação covalente na molécula de H2 (H-H) forma-se devido à sobreposição espacial (ou seja coalescência) de duas orbitais 1s dos átomos de H.
- 7. 2p Formação ddaa mmoollééccuullaa ddee ffllúúoorr ((FF22)) 2p F 2p F + F-F Teoria do Enlace da Valência + + + COALESCÊNCIA 1s H F H-F Formação da molécula de ácido fluorídrico
- 8. FFOORRMMAAÇÇÃÃOO DDEE MMOOLLÉÉCCUULLAASS FFOORRMMAAÇÇÃÃOO DDEE CCHH44 66 CC-- 11ss22 22ss22 22pp22 11 HH-- 11ss11 AAss oorrbbiittaaiiss uussaaddaass ppeellooss ááttoommooss eemm mmoollééccuullaass ppaarraa ffoorrmmaarr lliiggaaççõõeess nnããoo ssããoo nneecceessssaarriiaammeennttee aass mmeessmmaass qquuee aass oorrbbiittaaiiss ddooss ááttoommooss lliivvrreess..
- 9. FFOORRMMAAÇÇÃÃOO DDEE MMOOLLÉÉCCUULLAASS FFOORRMMAAÇÇÃÃOO DDEE CCHH44 66 CC-- 11ss22 22ss22 22pp22 aass oorrbbiittaaiiss ddee vvaallêênncciiaa ssããoo :: SSeerriiaa ddee eessppeerraarr qquuee oo ááttoommoo ddee ccaarrbboonnoo ffoorrmmaassssee aappeennaass dduuaass lliiggaaççõõeess ssiimmpplleess ccoomm ooss ááttoommooss ddee hhiiddrrooggéénniioo.. NNoo eennttaannttoo ,, aa mmoollééccuullaa ddee CCHH22 nnããoo éé eessttáávveell..
- 10. FFOORRMMAAÇÇÃÃOO DDEE MMOOLLÉÉCCUULLAASS FFOORRMMAAÇÇÃÃOO DDEE CCHH44 66 CC-- 11ss22 22ss22 22pp22 aass oorrbbiittaaiiss ddee vvaallêênncciiaa ssããoo :: PPaarraa iinntteerrpprreettaarr eessttaass lliiggaaççõõeess aa tteeoorriiaa ddoo eennllaaccee ddee vvaallêênncciiaa uuttiilliizzaa oo ccoonncceeiittoo ddee hhiibbrriiddaaççããoo.. AA hhiibbrriiddaaççããoo éé uumm pprroocceessssoo ddee mmiissttuurraa ddaass oorrbbiittaaiiss aattóómmiiccaass nnuumm ááttoommoo ((eemm ggeerraall oo cceennttrraall)),, ddee mmooddoo aa ggeerraarr uumm nnoovvoo ccoonnjjuunnttoo ddee oorrbbiittaaiiss –– cchhaammaaddaass oorrbbiittaaiiss hhííbbrriiddaass..
- 11. FFOORRMMAAÇÇÃÃOO DDEE MMOOLLÉÉCCUULLAASS FFOORRMMAAÇÇÃÃOO DDEE CCHH44 2p estado fundamental estado excitado estado híbrido 2s sp3 4 ligações C-H 6 C
- 12. Hibridação — coalescência de duas ou mais orbitais atómicas para formar um novo conjunto de orbitais híbridas. 1. Coalescência de, pelo menos, 2 orbitais atómicas não equivalentes (por ex., s e p). As orbitais híbridas têm uma forma diferente das orbitais atómicas originais. 2. Número de orbitais híbridas é igual ao número de orbitais atómicas puras que participam no processo de hibridação. 3. As ligações covalentes são formadas por: a. Sobreposição de orbitais híbridas com orbitais atómicas; b. Sobreposição de orbitais híbridas com outras orbitais híbridas.
- 13. Hibridação de orbitais aattóómmiiccaass:: ssããoo uummaa mmiissttuurraa ddee oorrbbiittaaiiss ((11)) HHiibbrriiddaaççããoo sspp33 nnoo ááttoommoo ddee ccaarrbboonnoo;; EExx:: CCHH44,, NNHH33 2s 2p 2s 2p 2sp3 Formam-se orbitais híbridas sp3 (no caso acima no átomo de carbono) a partir de orbitais s e p para descrever a formação de ligações químicas, quando o modelo RPECV prever o arranjo tetraédrico dos pares de electrões.
- 14. Outros exemplos ddee oouuttrrooss ttiippooss ddee hhiibbrriiddaaççããoo (2) Hibridação sp no átomo de Be, Ex: BeCl2 2s 2p 2s 2p sp (3) Hibridação sp2 no átomo de B; Ex: BF3 2s 2p 2s 2p sp2 2p orbital vazia
- 15. Ligação no CH4 Como justificar 4 ligações C—H sigma com um ângulo de 109º? Temos de usar 4 orbitais atómicas— s, px, py, e pz —para formar 4 orbitais híbridas.
- 17. Hibridação em moléculas com ligações duplas e tripla Ex: C2H4 (etileno) Podemos justificar a geometria e as ligações no etileno se admitirmos que cada átomo de carbono tem uma hibridação sp2. H H C C H H Geometria plana Da coalescência lateral das duas orbitais 2pz dos dois átomos de carbono, forma-se a ligação p C2H4 tem uma ligação dupla C=C em que as duas ligações covalentes são diferentes: uma ligação sigma (s ) e a outra é uma ligação pi (p ). Ligação sigma (s ): forma-se quando as moléculas coalescem de topo para formar uma ligação covalente, a nuvem electrónica resultante está concentrada entre os núcleos dos átomos envolvidos na ligação. Ligação pi (p ): forma-se quando a ligação é formada por orbitais que coalescem lateralmente, tem a nuvem electrónica concentrada acima e abaixo do plano dos núcleos dos átomos envolvidos na ligação.
- 18. etileno, C2H4 Hibridação sp2 de um átomo de carbono
- 21. Hibridação em moléculas com ligações duplas e tripla EX2:. C2H2; acetileno, tem geometria linear Podemos explicar a sua geometria e ligações se admitirmos que cada átomo de carbono tem uma hibridação sp. As 2 orbitais hibridas sp de cada átomo de carbono formam uma ligação sigma com o outro átomo de carbono. Além disso formam-se duas ligações p por coalescência lateral das duas orbitais 2py a 2pz não hibridas. Regra: C=C, a sua hibridação é sp2 , C C a sua hibridação é sp Exercício: Descreve as ligações químicas na molécula de formaldeído; H2CO
- 22. FFOORRMMAAÇÇÃÃOO DDEE MMOOLLÉÉCCUULLAASS Orbital híbrida Orientação sp Linear 180º sp2 Triangular Plana 120º sp3 Tetraédrica
- 23. FFOORRMMAAÇÇÃÃOO DDEE MMOOLLÉÉCCUULLAASS UUmmaa lliiggaaççããoo ssiimmpplleess éé uummaa lliiggaaççããoo ssiiggmmaa ((s )).. UUmmaa lliiggaaççããoo dduuppllaa ccoonnssiissttee nnuummaa lliiggaaççããoo ssiiggmmaa ee nnuummaa ppii ((p )).. UUmmaa lliiggaaççããoo ttrriippllaa ccoonnssiissttee nnuummaa lliiggaaççããoo ssiiggmmaa ee dduuaass lliiggaaççõõeess ppii ((p ))..
- 24. FORMAÇÃO DDEE MMOOLLÉÉCCUULLAASS OOss ááttoommooss lliiggaamm--ssee ccoomm aa ffiinnaalliiddaaddee ddee aaddqquuiirriirreemm mmaaiioorr eessttaabbiilliiddaaddee;; AA eenneerrggiiaa ddooss eelleeccttrrõõeess nnaa mmoollééccuullaa éé iinnffeerriioorr àà eenneerrggiiaa ddooss mmeessmmooss eelleeccttrrõõeess nnooss ááttoommooss sseeppaarraaddooss;; ÉÉ ddeevviiddoo àà pprreesseennççaa ddaa nnuuvveemm eelleeccttrróónniiccaa nnaa zzoonnaa iinntteerrnnuucclleeaarr qquuee ssee ccoommpprreeeennddee aa lliiggaaççããoo eennttrree ddooiiss ááttoommooss..
- 25. Formação de uma ligação sigma
